-
Ley de Boyle: volumen final de amoniaco (3860)
Una masa de amoniaco gaseoso ocupa un volumen de 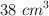 a 750 mm Hg. Halla su volumen a 630 mm Hg, si la temperatura permanece constante.
a 750 mm Hg. Halla su volumen a 630 mm Hg, si la temperatura permanece constante.
-
Leyes de los gases: ley de Boyle (3856)
Un litro de dióxido de carbono gaseoso a 27 grados centígrados y a presión atmosférica se lleva hasta una presión de 10 mm Hg. ¿Cuál será ahora el volumen que ocupa el gas si la temperatura no ha variado?
-
Globo que se asciende a temperatura constante 0001
Un globo inflado, que tiene un volumen de 0,55 litros a nivel del mar, se eleva a una altura de 6,5 kilómetros, donde la presión es de 0,40 atm. Suponiendo que la temperatura permanece constante durante el ascenso, ¿cuál es el volumen final del globo?
-
Volumen final de un gas al variar su presión y temperatura
Un gas ocupa un volumen de 2 L en condiciones normales. ¿Qué volumen ocupará esta misma masa de gas a 2 atm y 50 ºC?
-
Repaso: Temperatura que puede soportar un envase de un aerosol (3794)
Es peligroso que los envases de aerosoles se expongan al calor. Si un bote de fijador para el cabello, a una presión de 4 atm y a una temperatura ambiente de 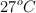 se arroja al fuego, ¿cuál será la temperatura en el interior del bote a la que es probable que explote el envase si la presión máxima que es capaz de soportar es de 7 500 mm Hg?
se arroja al fuego, ¿cuál será la temperatura en el interior del bote a la que es probable que explote el envase si la presión máxima que es capaz de soportar es de 7 500 mm Hg?
 Leyes de los gases
Leyes de los gases