-
Relación másica en una reacción para calcular masas de productos y reactivos que reaccionan
Con respecto a la reacción siguiente:
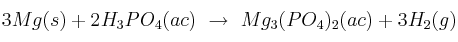
y considerando que reaccionan 0,482 mol de 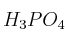 , calcula, expresando el resultado en gramos:
, calcula, expresando el resultado en gramos:
a) La máxima cantidad de Mg que se consume durante la reacción.
b) La máxima cantidad de 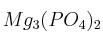 que se puede formar.
que se puede formar.
c) La máxima cantidad de hidrógeno que se puede producir.
d) La cantidad de 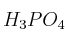 que se consume durante la reacción.
que se consume durante la reacción.
Masas atómicas: Mg = 24,3 ; H = 1 ; P = 31 ; O = 16
-
Volumen de benceno que se quema para obtener una masa de carbonato de bario (5385)
Se quema una muestra de benceno, 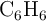 , produciendo
, produciendo  y
y 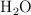 . El
. El  producido se absorbe en una solución acuosa de
producido se absorbe en una solución acuosa de 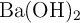 y el producto precipitado,
y el producto precipitado, 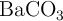 , tiene una masa de 0.53 g. Si la densidad del benceno líquido es 0.879 g/mL, calcula el volumen de la muestra líquida quemada.
, tiene una masa de 0.53 g. Si la densidad del benceno líquido es 0.879 g/mL, calcula el volumen de la muestra líquida quemada.
Masas moleculares (g/mol): 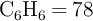 ;
; 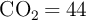 ;
; 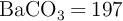
-
Estequiometría en masa, reactivo limitante y moles de reactivo en exceso
Dada la reacción ajustada: 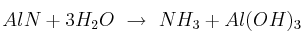
a) ¿Cuál es la relación estequiométrica en masa, expresada en gramos, para la reacción?
b) Si se colocaron 100 g de AlN, cuya pureza era de 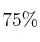 , y 100 g de agua pura, ¿qué masa, en gramos, y cuántos moles de
, y 100 g de agua pura, ¿qué masa, en gramos, y cuántos moles de 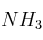 se produjeron? Indica en este caso cuál es el reactivo limitante y el reactivo en exceso.
se produjeron? Indica en este caso cuál es el reactivo limitante y el reactivo en exceso.
c) ¿Cuántos moles de moléculas del reactivo en exceso quedaron sin reaccionar?
Masas atómicas: Al = 27 ; N = 14 ; O = 16 ; H = 1.
-
Masa de sulfato de cobre(II) que se obtiene a partir de 127 g de cobre (5245)
¿Cuántos gramos de 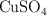 se obtienen al reaccionar 127 gramos de cobre? La reacción que tiene lugar es:
se obtienen al reaccionar 127 gramos de cobre? La reacción que tiene lugar es:

Datos: Cu = 63.5 ; S = 32 ; O = 16 ; H = 1.
-
Masa de nitrato de sodio a partir de ácido nítrico y carbonato de sodio (4971)
Se hacen reaccionar 10 moles de ácido nítrico con carbonato de sodio. Determina cuántos gramos de nitrato de sodio se obtienen.
Masas atómicas: Na = 23 ; O = 16 ; N = 14.
 Mol
Mol