-
Volumen de hidrógeno que se obtiene al reaccionar níquel con ácido nítrico (5810)
Se hace reaccionar en un recipiente 23.5 g de una lámina de níquel metálico con acido nítrico al 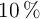 (m/V) según la reacción:
(m/V) según la reacción:
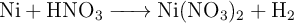
a) ¿Qué volumen de 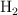 , a una presión de 912 mm Hg y a
, a una presión de 912 mm Hg y a 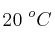 , se obtiene si la reacción se produce con un rendimiento del
, se obtiene si la reacción se produce con un rendimiento del 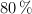 ?
?
b) ¿Qué volumen mínimo necesito agregar al recipiente para que se produzca la reacción?
-
Reducción del nitrobenceno a anilina con ditionito de sodio en medio básico (5516)
Se desean sintetizar 150 g de anilina a partir de nitrobenceno. Sabiendo que solo el 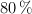 del nitrobenceno se transforma en anilina en la reacción:
del nitrobenceno se transforma en anilina en la reacción:

a) Realiza el ajuste de la ecuación por el método ion-electrón.
b) Identifica el agente reductor y el agente oxidante.
c) Calcula las masas de nitrobenceno, NaOH y de 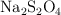 que serán necesarias para obtener la masa deseada de anilina.
que serán necesarias para obtener la masa deseada de anilina.
Datos en 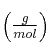 : H = 1 ; C = 12 ; S = 32 ; N = 14 ; O = 16 ; Na = 23.
: H = 1 ; C = 12 ; S = 32 ; N = 14 ; O = 16 ; Na = 23.
-
Reactivo limitante y masa de producto a partir de reactivos impuros (5499)
La siguiente es una reacción espontánea del aluminio metálico con bromo, un no metal líquido. La ecuación es la siguiente:
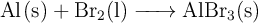
a) Si se hicieron reaccionar 12 g de aluminio (al 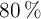 de pureza) y 56 g de bromo (al
de pureza) y 56 g de bromo (al 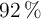 de pureza), ¿cuál es la sustancia que actúa como reactivo limitante?
de pureza), ¿cuál es la sustancia que actúa como reactivo limitante?
b) ¿Cuántos gramos de bromuro de aluminio se producen si el rendimiento de la reacción es del 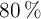 ?
?
Masas atómicas: Al = 27 y Br = 80.
-
Electrolisis de nitrato de plata: concentración y neutralización de iones resultantes (5338)
Se lleva a cabo la electrolisis de 3 L de disolución acuosa de nitrato de plata (0.25 M) haciendo circular una corriente de 6 A. Sabiendo que el rendimiento del proceso es del 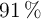 :
:
a) Escribe las semirreacciones que se llevan a cabo y realiza un esquema del proceso electrolítico, indicado la polaridad de los electrodos y la marcha de los electrones.
b) Calcula el tiempo que se hizo circular la corriente eléctrica mencionada, sabiendo que se depositaron 3.85 g del metal.
c) Calcula la concentración de todos los iones que quedan en disolución después del proceso de electrolisis.
d) Calcula el volumen de hidróxido de calcio 0.5 M o de ácido clorhídrico 0.4 M que habría que habría que agregar al finalizar la electrolisis para que el pH de la disolución resulte neutro.
-
Aplicación de reactivo limitante, pureza de reactivos y rendimiento de reacción (5176)
Se dispone de 87 g de nitrato de plata, con el 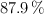 de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al
de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al 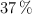 en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del
en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del 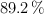 .
.
a) Escribe la reacción química y ajústala si fuera necesario.
b) Calcula la cantidad de cloruro de plata y de ácido nítrico que se obtiene en la reacción.
c) Determina la cantidad del reactivo en exceso que no reacciona.
Masas atómicas: H = 1 ; O = 16 ; N = 14 ; Cl = 35.5 ; Ag = 108.
 Rendimiento
Rendimiento