-
Cuestión cinética química 0003
Define velocidad de reacción, orden de reacción y molecularidad. Explica sus posibles diferencias para el caso:
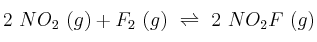
y justifica cómo se lograría aumentar más la rapidez de la reacción:
a) Duplicando la cantidad inicial de dióxido de nitrógeno.
b) Duplicando la cantidad inicial de flúor.
-
Definición de conceptos de cinética química (570)
Explica brevemente el significado de los siguientes conceptos cinéticos:
a) Velocidad de reacción.
b) Ecuación de velocidad.
c) Energía de activación.
d) Orden de reacción.
-
Problema cinética química 0005
A 600 K, el valor de la constante de velocidad de la descomposición de una sustancia A es 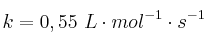 :
:
a) ¿Cuál es la velocidad de descomposición de la sustancia a esta temperatura si ![[A] = 3\cdot 10^{-3}\ mol/L [A] = 3\cdot 10^{-3}\ mol/L](local/cache-TeX/f726b654245ff6e2e567329fc1a0c7d7.png) ?
?
b) Si a 625 K la constante de velocidad es 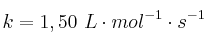 , ¿cuánto vale la energía de activación?
, ¿cuánto vale la energía de activación?
c) Fijándote en las unidades de la constante, ¿serías capaz de decir cuál es el orden de reacción de la descomposición de A?
-
Cuestión de cinética química: estequiometría y orden de reacción (564)
Para el siguiente equilibrio:
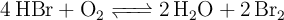
¿Crees que es posible que se trate de un proceso elemental en el coincidan, en la ecuación de velocidad, los órdenes parciales con los coeficientes estequiométricos? ¿Por qué?
-
Constante de velocidad y orden de reacción de un proceso a partir de datos de velocidad (563)
Para una determinada reacción, 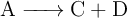 , se ha medido la velocidad a partir de distintas concentraciones iniciales de A y se han registrado los resultados en la tabla:
, se ha medido la velocidad a partir de distintas concentraciones iniciales de A y se han registrado los resultados en la tabla:
![\begin{tabular}{| c | c | } \hline [A] (M)&v (M\cdot s^{-1})\\\hline 0.1&0.15\\\hline 0.2&1.2\\\hline 0.3&4.05\\\hline \end{tabular} \begin{tabular}{| c | c | } \hline [A] (M)&v (M\cdot s^{-1})\\\hline 0.1&0.15\\\hline 0.2&1.2\\\hline 0.3&4.05\\\hline \end{tabular}](local/cache-TeX/45abba4222ed10a7ba933cdf94fb6068.png)
Calcula el orden de reacción y la constante de velocidad.
 Orden de reacción
Orden de reacción