Calcula el número de átomos que habría en un cilindro de ![]() de diámetro y
de diámetro y ![]() de longitud de:
de longitud de:
a) Magnesio (![]() )
)
b) Plomo (![]() )
)
Considerando el número de Avogadro, determina cuántas moléculas de gas caben en una esfera de 7 cm de radio, en condiciones normales.
![]()
Un automóvil consume 1 galón de combustible por cada 15 km recorridos. La densidad del combustible es de 6 lb/gal. El automóvil emite 0,41 g/km de dióxido de carbono. ¿Qué fracción (en porcentaje) del combustible alimentado al automóvil se emite?
Se tiene un sistema formado por 87,5 g de ![]() ; 1,87 mol de
; 1,87 mol de ![]() y 127,6 g de
y 127,6 g de ![]() . ¿Qué porcentaje de las moléculas del sistema son de
. ¿Qué porcentaje de las moléculas del sistema son de ![]() ?
?
Masas moleculares (g/mol): ![]() ;
; ![]() ;
; ![]() .
.
Determina el porcentaje de hidrógeno en la molécula de agua.
A 100 g de agua se le agregan 450 g de una disolución al ![]() (m/m) y 250 g de otra disolución al
(m/m) y 250 g de otra disolución al ![]() (m/m), ambas del mismo soluto. ¿Cuál es la concentración final expresada en porcentaje en masa?
(m/m), ambas del mismo soluto. ¿Cuál es la concentración final expresada en porcentaje en masa?
El ácido sulfúrico (![]() ) comercial es un líquido con densidad de 1,84 g/mL que está al
) comercial es un líquido con densidad de 1,84 g/mL que está al ![]() . Realiza los cálculos e indica el procedimiento para preparar 250 mL de una disolución 0,5 M. ¿Cuáles son los instrumentos de laboratorio adecuados para la preparación de la disolución?
. Realiza los cálculos e indica el procedimiento para preparar 250 mL de una disolución 0,5 M. ¿Cuáles son los instrumentos de laboratorio adecuados para la preparación de la disolución?
Determina la presión que ejercen 0,2 moles de gas ideal a ![]() cuando ocupa un volumen de 410 mL.
cuando ocupa un volumen de 410 mL.
¿Qué presión generan 4 g de hielo seco, ![]() , expresada en psi, si se confinan en un recipiente hermético de 100 mL, a
, expresada en psi, si se confinan en un recipiente hermético de 100 mL, a ![]() , una vez que pasa a estado gaseoso? Datos: C = 12 ; O = 16 ;
, una vez que pasa a estado gaseoso? Datos: C = 12 ; O = 16 ; 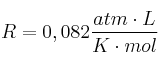 ; 1 atm = 14,7 psi.
; 1 atm = 14,7 psi.
 Ejercicios FyQ
Ejercicios FyQ