-
Estequiometría de la reacción entre cinc y ácido sulfúrico (2351)
Se tratan 4.9 g de ácido sulfúrico con cinc. En la reacción se obtiene sulfato de cinc e hidrógeno.
a) Formula y ajusta la reacción que tiene lugar.
b) Calcular la cantidad de hidrógeno desprendido.
c) Halla qué volumen ocupará ese hidrógeno en condiciones normales.
-
Reacciones con reactivos en disolución 0001
¿Qué cantidad de cobre se necesita para que reaccione con 25 mL de ácido nítrico concentrado (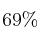 de concentración en masa y una densidad de 1,49
de concentración en masa y una densidad de 1,49 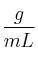 ) en las condiciones de laboratorio (T =
) en las condiciones de laboratorio (T = 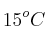 y 540 mm Hg)?
y 540 mm Hg)?
Suponer que la reacción da lugar al bis-[trioxidonitrato] de cobre.
-
Estequiometría y cálculo con masas 0001
¿Qué masa de 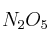 resulta necesaria para obtener 3 150 g de ácido nítrico (
resulta necesaria para obtener 3 150 g de ácido nítrico (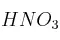 ), a partir de la reacción
), a partir de la reacción 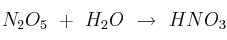 ?
?
¿Cuántos moles de agua reaccionarán?
-
Reactivos con impurezas 0002
¿Qué masa de trióxido de azufre (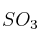 ) se podrá obtener a partir de 250 gramos de azufre con un 98
) se podrá obtener a partir de 250 gramos de azufre con un 98 de pureza?
de pureza?
La reacción que tiene lugar es: 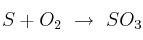
-
Reacciones químicas: reactivos impuros 0002
Se hace reaccionar 150 gramos de una muestra de 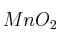 que posee una pureza del 87
que posee una pureza del 87 con suficiente cantidad de HCl. Determina:
con suficiente cantidad de HCl. Determina:
a) Moles y masa del agua que se obtiene.
b) Moles y masa de cloro.
 Ajuste
Ajuste