-
Presión final de una mezcla de gases (6150)
Tres frascos de 1 L, todos a 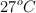 , han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de
, han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de 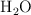 , el segundo contiene
, el segundo contiene 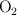 a la presión de 1 atm y el tercero 1 g de
a la presión de 1 atm y el tercero 1 g de 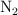 . A la temperatura de
. A la temperatura de 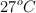 , la presión de vapor del agua es 0.038 atm. Calcula:
, la presión de vapor del agua es 0.038 atm. Calcula:
a) La presión inicial en cada frasco.
b) Si se abren las espitas y se espera a que se alcance el equilibrio, ¿cuál será la presión en el sistema?
c) Si la temperatura del sistema se eleva a 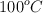 , ¿cuál será entonces la presión?
, ¿cuál será entonces la presión?
-
Masa molecular de un gas encerrado y masa de otro gas para un valor de presión final
En un recipiente de paredes rígidas y de 20 L de capacidad hay encerrados 50.19 g de un gas formado por C, H, y O a  que ejercen una presión de 1.4 atm.
que ejercen una presión de 1.4 atm.
a) Halla la masa molecular del gas.
b) Calcula la masa del monóxido de carbono que hay que añadir para que la presión resultante sea de 2.0 atm, manteniendo la temperatura constante.
Datos: C = 12 ; O = 16 ; H = 1 ; 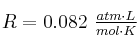
-
Masa de una molécula de etano (5920)
¿Cuál es la masa de una molécula de etano (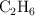 )?
)?
Masas atómicas: H = 1 ; O = 16. Número de Avogadro: 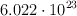 .
.
-
Átomos, moléculas, moles y gramos en una muestra de glucosa (5868)
Una muestra de glucosa, 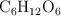 , contiene
, contiene 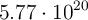 átomos de carbono.
átomos de carbono.
a) ¿Cuántos átomos de hidrógeno contiene?
b) ¿Cuántas moléculas de glucosa contiene?
c) ¿Cuántos moles de glucosa contiene?
d) Calcula la masa de la muestra en gramos.
-
Masa, volumen y número de átomos de un alambre de cobre (5679)
Un alambre de cobre de 10 cm de longitud y 0.25 cm de diámetro tiene una densidad de 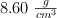 . Calcula:
. Calcula:
a) La masa y el volumen del alambre.
b) El número de átomos de cobre que contiene.
Datos: Cu = 63.45 ; 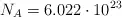
 Mol
Mol