-
Selectividad septiembre 2012: Ajuste redox y estequiometría 0001
El ácido sulfúrico concentrado reacciona con el bromuro de potasio para dar bromo, dióxido de azufre, sulfato de potasio y agua.
a) Escribe y ajusta la ecuación molecular por el método del ion-electrón.
b) Calcula los gramos de bromo que se producirán cuando se traten 50 g de bromuro de potasio con exceso de ácido sulfúrico.
Masas atómicas: K=39; Br=80.
-
Electroquímica: electrodeposición y estequiometría 0001
Al pasar una corriente eléctrica por una disolución acuosa de nitrato de cobalto(II) se desprende oxígeno en el ánodo y se deposita cobalto en el cátodo. Calcula:
a) La intensidad de la corriente que se necesita para depositar 8,42 g de Co de una disolución acuosa de 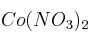 en 35 minutos.
en 35 minutos.
b) El volumen de oxígeno gaseoso, medido en condiciones normales, que se desprende en el ánodo.
Datos: F = 96500 C. Masas atómicas: N = 14; O = 16; Co = 59
-
Ley de Faraday y esquiometría 0001
Al hacer la electrolisis del cloruro de sodio, se depositan 12 g de sodio en el cátodo. Calcula:
a) Los moles de cloro gaseoso liberados en el ánodo.
b) El volumen que ocupa el cloro del apartado anterior a 700 mm de Hg y 100 ºC.
Masas atómicas: Na = 23; Cl = 35,5
-
Ajuste ion-electrón y estequiometría 0001
El ácido sulfúrico concentrado reacciona con el bromuro de potasio según la reacción:
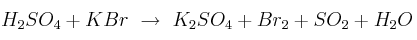
a) Ajusta, por el método del ion-electrón, la reacción anterior.
b) Calcula el volumen de bromo líquido (densidad 2,92 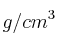 ) que se obtendrá al tratar 90,1 g de bromuro de potasio con suficiente cantidad de ácido sulfúrico.
) que se obtendrá al tratar 90,1 g de bromuro de potasio con suficiente cantidad de ácido sulfúrico.
Masas atómicas: K = 39; Br = 80
-
Reacciones redox: Ajuste y estequiometría 0002
Dada la reacción redox en disolución acuosa:
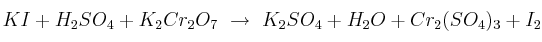
a) Ajuste por el método del ion-electrón la reacción.
b) Calcule la molaridad de la disolución de dicromato de potasio, si 30 mL de la misma reaccionan con 60 mL de una disolución que contiene 80 g/L de yoduro de potasio.
Masas atómicas: O = 16; K = 39; Cr = 52; I = 127
 Estequiometría
Estequiometría