-
Ley de Boyle: volumen final de amoniaco (3860)
Una masa de amoniaco gaseoso ocupa un volumen de 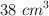 a 750 mm Hg. Halla su volumen a 630 mm Hg, si la temperatura permanece constante.
a 750 mm Hg. Halla su volumen a 630 mm Hg, si la temperatura permanece constante.
-
Leyes de los gases: ley de Boyle (3856)
Un litro de dióxido de carbono gaseoso a 27 grados centígrados y a presión atmosférica se lleva hasta una presión de 10 mm Hg. ¿Cuál será ahora el volumen que ocupa el gas si la temperatura no ha variado?
-
Globo que se asciende a temperatura constante 0001
Un globo inflado, que tiene un volumen de 0,55 litros a nivel del mar, se eleva a una altura de 6,5 kilómetros, donde la presión es de 0,40 atm. Suponiendo que la temperatura permanece constante durante el ascenso, ¿cuál es el volumen final del globo?
-
Ley de Boyle: volumen final de un gas (3100)
Una muestra de cloro gaseoso ocupa un volumen de 430 mL a una presión de 780 torr. ¿Cuál será el volumen de la muestra a una presión de 420 torr?
-
Ley de Boyle: presión final de un gas (3099)
¿A qué presión se debe someter una muestra de gas a temperatura constante para comprimirlo de 18 L a 8.2 L si su presión inicial es de 1.7 atm?
 Ley de Boyle
Ley de Boyle