-
Molaridad y concentración g/L de una base que es neutralizada con ácido sulfúrico (6123)
Calcula la concentración en g/L y en mol/L de una disolución de hidróxido de potasio si 25 mL de la misma reaccionan con 40 mL de una disolución de ácido sulfúrico 0.1 M, teniendo en cuenta que los productos de la reacción son sulfato de potasio y agua.
Masas atómicas: K = 39 ; H = 1 ; O = 16.
-
Estandarización de una solución de NaOH y posterior valoración de una disolución de HCl (6094)
Un disolución de NaOH se estandariza con hidrogenoftalato de potasio y se registran los siguientes datos; masa de ftalato: 0.8707 g, lectura inicial de la bureta: 0.23 mL, lectura final de la bureta: 38.78 mL.
Posteriormente se utiliza esta disolución para la valoración de una disolución de HCl en la que una muestra de 30.0 mL necesitó un volumen de 34.21 mL de la disolución estandarizada. ¿Cuál es la molaridad de la disolución de HCl?
Masas atómicas: K = 39, C = 12, O = 16, H = 1, Na = 23.
-
pH final de una mezcla de disoluciones de HCl y NH3 (5471)
¿Qué pH tendrá una disolución de 20.0 mL de HCl de concentración 0.5 M a la que se le añaden 60.0 mL de 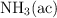 de 0.5 M de concentración?
de 0.5 M de concentración?
Dato: 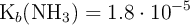
-
Normalidad de un ácido a partir del volumen y normalidad de la base
¿Cuál es la normalidad de 25 mL de HCl, si se han necesitado 35 mL de NaOH 0.1 N para su neutralización?
-
Volumen de ácido necesario para neutralizar 2.5 g de NaOH (5456)
¿Qué volumen de 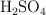 (5 N) se necesita para neutralizar una solución que contiene 2.5 g de
(5 N) se necesita para neutralizar una solución que contiene 2.5 g de 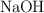 ? ¿Cuántos gramos de
? ¿Cuántos gramos de 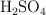 puro se necesitan?
puro se necesitan?
 Neutralización
Neutralización