-
Volumen de hidrógeno que se desprende al reaccionar Zn con H2SO4
¿Qué volumen de hidrógeno, medido a 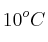 y 1,5 atm, se desprende al tratar 150 g de cinc con exceso de ácido sulfúrico?
y 1,5 atm, se desprende al tratar 150 g de cinc con exceso de ácido sulfúrico?
Masas atómicas: Zn = 65,3 ; S = 32 ; O = 32 ; H = 1.
-
Volumen de oxígeno necesario y masa de CdO obtenida en una reacción (5392)
Se calienta una muestra de cadmio de 13 g de masa en atmósfera de oxígeno, produciéndose óxido de cadmio. Calcula:
i) El volumen de oxígeno necesario para su completa combustión, medido en condiciones normales.
ii) Masa de óxido de cadmio formada, expresada en gramos.
Masas atómicas: Cd = 112.4 y O = 16.
-
Volumen de N2O3, reactivo limitante y masa que sobra de un reactivo
¿Cuántos litros de trióxido de dinitrógeno se producen, en condiciones normales, cuando se hacen reaccionar 30 g de nitrógeno con 1,2 moles de oxígeno? ¿Cuál es el reactivo limitante? ¿Qué masa sobra del reactivo en exceso?
Masas atómicas: N = 14 ; O = 16.
-
Masa de magnesio impuro necesaria para obtener un volumen de hidrógeno
Una masa de magnesio reacciona con cantidad suficiente de ácido clorhídrico. ¿Cuántos gramos de magnesio, con una pureza del  , se necesitan para obtener 25 L de hidrógeno medidos a 667 mm Hg y
, se necesitan para obtener 25 L de hidrógeno medidos a 667 mm Hg y 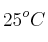 ?
?
Masa atómica del Mg = 24,3 ; 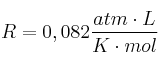
-
Pureza de una muestra de cinc a partir de su reacción con HCl (4988)
La reacción entre el cinc y el ácido clorhídrico produce cloruro de cinc e hidrógeno. Para determinar la riqueza de un cinc muy impuro se tomaron 5 g de muestra y se hicieron reaccionar con ácido clorhídrico en exceso. El volumen de hidrógeno producido fue de 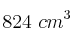 , medido a 1 atm y 298 K, ¿qué porcentaje de cinc hay en la muestra?
, medido a 1 atm y 298 K, ¿qué porcentaje de cinc hay en la muestra?
Datos: 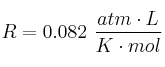 ; Zn = 65.3 g/mol.
; Zn = 65.3 g/mol.
 Gases
Gases