-
Velocidad de reacción en dos tubos de ensayo con distintas concentraciones
Se tienen dos tubos de ensayo en los que se agregan 3 mL de ácido sulfúrico al 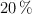 . En el primer tubo se deja caer una cinta de magnesio de 3 g y en el segundo tubo 3 g de cobre. Para culminar la reacción en el primer tubo transcurrieron 100 s y en el segundo tubo 300 s. ¿Cuál fue la velocidad de reacción para cada experiencia?
. En el primer tubo se deja caer una cinta de magnesio de 3 g y en el segundo tubo 3 g de cobre. Para culminar la reacción en el primer tubo transcurrieron 100 s y en el segundo tubo 300 s. ¿Cuál fue la velocidad de reacción para cada experiencia?
-
Reactivo limitante y en exceso en la neutralización de HCl y NaOH (6520)
Se añaden 20 mL de ácido clorhídrico 8 M a un matraz que contiene 100 mL de una disolución de hidróxido de sodio 1.5 M, formándose cloruro de sodio y agua.
a) Escribe y ajusta la reacción.
b) Indicar cuál es el reactivo limitante y cuál está exceso.
c) Calcula la cantidad del reactivo en exceso que queda sin reaccionar.
Masas atómicas: H = 1; Cl =35.5
-
Concentración de un ácido usado para neutralizar una disolución de NaOH
Se tienen 5 g de hidróxido de sodio, a los cuales se les agrega agua hasta alcanzar un volumen de 250 mL y se utilizan 25 mL de esta disolución para titular una alícuota de 50 mL de ácido clorhídrico. Calcula la molaridad del ácido.
-
Valoración de una dilución de una botella de ácido sabiendo el volumen de base
Se toman 5 mL de una botella de 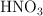 con el fin de conocer su concentración molar. Esta alícuota se diluye en un matraz aforado de 500 mL y se toman 10 mL, consumiendo 25 mL de NaOH (0.1M) para llegar al punto de equivalencia con fenolftaleina. ¿Cuál es la concentración molar de la botella de
con el fin de conocer su concentración molar. Esta alícuota se diluye en un matraz aforado de 500 mL y se toman 10 mL, consumiendo 25 mL de NaOH (0.1M) para llegar al punto de equivalencia con fenolftaleina. ¿Cuál es la concentración molar de la botella de 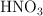 ?
?
-
Porcentaje en plata de una moneda que es valorada con NaOH (6485)
Una moneda de plata, cuya masa es de 4.652 g, se disuelve en ácido nítrico y se lleva a un volumen de 200 mL. Se toman 10 mL de esta solución y se titulan o valoran adecuadamente con una solución 0.1 N de NaOH, de la cual se gastan 19.45 mL. Hallar el tanto por ciento en masa-masa de plata en dicha moneda.
 Molaridad
Molaridad