-
Fracción molar y molalidad de una disolución (2206)
Una solución contiene el 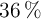 en masa de HCl:
en masa de HCl:
a) Calcula la fracción molar de HCl.
b) Calcula la molalidad del HCl en la disolución.
-
Presión parcial de un gas en una mezcla (2190)
Una mezcla de 50 g de oxígeno y 50 g de metano se coloca en un recipiente a la presión de 600 mm Hg. ¿Cuál será la presión parcial del oxígeno molecular?
-
Disoluciones: molaridad y fracción molar 0001
En una botella de ácido clorhídrico concentrado figuran los siguientes datos: 36 en masa, densidad 1,18 g/mL. Calcula:
en masa, densidad 1,18 g/mL. Calcula:
a) La molaridad de la disolución y la fracción molar del ácido.
b) El volumen de este ácido concentrado que se necesita para preparar un litro de disolución 2 M.
Masas atómicas: Cl = 35,5 ; H = 1 ; O = 16.
-
Mezcla de gases: mol, moléculas y átomos 0001
Se introducen 15 g de etano en una botella de 3 L de capacidad a 30 ºC:
a) ¿Cuál es la presión del gas en el recipiente?
b) ¿Cuántos átomos de hidrógeno hay?
c) Si los átomos presentes estuviesen todos libres, sin formar enlaces, y en estado gaseoso, ¿cuál sería la presión parcial del hidrógeno?
Datos: C = 12 ; H = 1 ; R = 0,082 atm·L/mol·K
-
Problema disoluciones 0006
¿Cuál será la presión de vapor a 80 ºC de una disolución que se prepara disolviendo 30 mL de glicerina (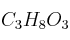 ) en 70 mL de agua? Datos: Presión de vapor del agua a 80 ºC = 355 mm de Hg; densidad (glicerina) = 1,26 g/mL; densidad (agua) = 1 g/mL.
) en 70 mL de agua? Datos: Presión de vapor del agua a 80 ºC = 355 mm de Hg; densidad (glicerina) = 1,26 g/mL; densidad (agua) = 1 g/mL.
 Fracción molar
Fracción molar