-
Volumen de N2O3, reactivo limitante y masa que sobra de un reactivo
¿Cuántos litros de trióxido de dinitrógeno se producen, en condiciones normales, cuando se hacen reaccionar 30 g de nitrógeno con 1,2 moles de oxígeno? ¿Cuál es el reactivo limitante? ¿Qué masa sobra del reactivo en exceso?
Masas atómicas: N = 14 ; O = 16.
-
Estequiometría en masa, reactivo limitante y moles de reactivo en exceso
Dada la reacción ajustada: 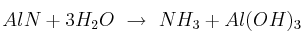
a) ¿Cuál es la relación estequiométrica en masa, expresada en gramos, para la reacción?
b) Si se colocaron 100 g de AlN, cuya pureza era de 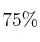 , y 100 g de agua pura, ¿qué masa, en gramos, y cuántos moles de
, y 100 g de agua pura, ¿qué masa, en gramos, y cuántos moles de 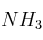 se produjeron? Indica en este caso cuál es el reactivo limitante y el reactivo en exceso.
se produjeron? Indica en este caso cuál es el reactivo limitante y el reactivo en exceso.
c) ¿Cuántos moles de moléculas del reactivo en exceso quedaron sin reaccionar?
Masas atómicas: Al = 27 ; N = 14 ; O = 16 ; H = 1.
-
Aplicación de reactivo limitante, pureza de reactivos y rendimiento de reacción (5176)
Se dispone de 87 g de nitrato de plata, con el 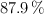 de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al
de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al 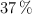 en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del
en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del 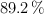 .
.
a) Escribe la reacción química y ajústala si fuera necesario.
b) Calcula la cantidad de cloruro de plata y de ácido nítrico que se obtiene en la reacción.
c) Determina la cantidad del reactivo en exceso que no reacciona.
Masas atómicas: H = 1 ; O = 16 ; N = 14 ; Cl = 35.5 ; Ag = 108.
-
Reacción de formación del agua entre gases en distintas condiciones (4850)
Si tenemos 50 L de hidrógeno a 293 K y 2 atm y 30 L de oxígeno a 303 K y 3 atm, y los hacemos reaccionar para dar agua, ¿qué volumen de agua podremos obtener a 4 atm y 313 K? ¿Qué reactivo y en qué cantidad sobrará?
-
Presión final en un reactor tras la formacion de agua
Un recipiente de 1 L contiene hidrógeno gaseoso a 326 torr y 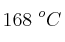 y oxígeno gaseoso a 652 torr y la misma temperatura. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción
y oxígeno gaseoso a 652 torr y la misma temperatura. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción 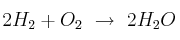 . ¿Cuál será la presión final en el recipiente si la temperatura final es
. ¿Cuál será la presión final en el recipiente si la temperatura final es 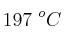 ?
?
 Reactivo limitante
Reactivo limitante