-
Principio de Le Chatelier: factores que afectan al equilibrio químico (1623)
Para la siguiente reacción exotérmica en el equilibrio:
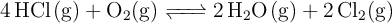
Razona cuál es el efecto sobre la concentración de HCl en el equilibrio en los siguientes casos:
a) Aumento de la concentración de 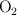
b) Disminución de la concentración de 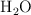
c) Aumento del volumen del sistema.
d) Reducción de la temperatura del sistema.
e) Añadir un gas inerte como He.
f) Introducir un catalizador positivo.
-
Constante de equilibrio y Principio de Le Chatelier 0002
En un matraz de 20 L, a 25 ºC, se encuentran en equilibrio 2,14 moles de 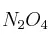 y 0,50 moles de
y 0,50 moles de 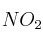 según:
según: 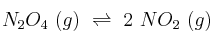
a) Calcule el valor de las constantes 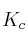 y
y 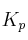 a esa temperatura.
a esa temperatura.
b) ¿Cuál es la concentración de 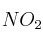 cuando se restablece el equilibrio después de introducir dos moles adicionales de
cuando se restablece el equilibrio después de introducir dos moles adicionales de 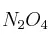 , a la misma temperatura?
, a la misma temperatura?
Dato: R = 0,082 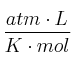
-
EBAU Andalucía: química (junio 2011) - ejercicio B.6 (1470)
En un recipiente de 2 L se introducen 2.1 mol de  y 1.6 mol de
y 1.6 mol de 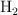 y se calienta a
y se calienta a 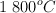 . Una vez alcanzado el siguiente equilibrio:
. Una vez alcanzado el siguiente equilibrio:

se analiza la mezcla y se encuentra que hay 0.9 mol de  . Calcula:
. Calcula:
a) La concentración de cada especie en el equilibrio.
b) El valor de las constantes  y
y  a esa temperatura.
a esa temperatura.
-
Problema equilibrio químico 0016
En un recipiente de 3 L se introducen 0,60 moles de 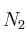 y 0,36 moles de
y 0,36 moles de 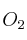 . Calentamos el recipiente hasta los 650 ºC y se establece el equilibrio:
. Calentamos el recipiente hasta los 650 ºC y se establece el equilibrio:
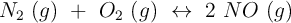
En estas condiciones reacciona el 5,3 del nitrógeno existente. Calcula el valor de
del nitrógeno existente. Calcula el valor de  a esa temperatura y la presión total en el recipiente cuando se ha alcanzado el equilibrio.
a esa temperatura y la presión total en el recipiente cuando se ha alcanzado el equilibrio.
-
UNED equilibrio químico 0002
En un recipiente se introducen 2,94 moles de yodo y 8,10 moles de hidrógeno, estableciéndose el equilibrio cuando se han formado 5,60 moles de yoduro de hidrógeno. A la temperatura de la experiencia todas las sustancias son gaseosas. Calcular: a) Las cantidades de yodo e hidrógeno que han reaccionado; b) La constante de equilibrio de la reacción.
 Concentraciones
Concentraciones