-
Electrolisis de nitrato de plata: concentración y neutralización de iones resultantes (5338)
Se lleva a cabo la electrolisis de 3 L de disolución acuosa de nitrato de plata (0.25 M) haciendo circular una corriente de 6 A. Sabiendo que el rendimiento del proceso es del 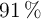 :
:
a) Escribe las semirreacciones que se llevan a cabo y realiza un esquema del proceso electrolítico, indicado la polaridad de los electrodos y la marcha de los electrones.
b) Calcula el tiempo que se hizo circular la corriente eléctrica mencionada, sabiendo que se depositaron 3.85 g del metal.
c) Calcula la concentración de todos los iones que quedan en disolución después del proceso de electrolisis.
d) Calcula el volumen de hidróxido de calcio 0.5 M o de ácido clorhídrico 0.4 M que habría que habría que agregar al finalizar la electrolisis para que el pH de la disolución resulte neutro.
-
Porcentaje de nitrógeno en un alimento a partir de una valoración
Se tienen 2 g de un producto alimenticio que son descompuestos mediante reacciones químicas, por lo que el nitrógeno pasa al estado de ión amonio. Después del ataque el líquido se diluye, se alcaliniza y se destila. El 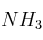 desprendido se neutraliza con 25 mL de
desprendido se neutraliza con 25 mL de 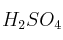 (0,5 N). Al final de la destilación, el exceso de ácido se valora con NaOH, gastándose 16,4 mL de la solución 0,5 M. Determina el porcentaje de nitrógeno en el producto.
(0,5 N). Al final de la destilación, el exceso de ácido se valora con NaOH, gastándose 16,4 mL de la solución 0,5 M. Determina el porcentaje de nitrógeno en el producto.
-
Volumen de NaOH necesario para neutralizar disolución 0.5 N de ácido sulfúrico
¿Qué volumen de una solución de hidróxido de sodio (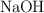 ), de concentración 0.250 mol/L, se necesita para neutralizar 45 mL de una solución acuosa de ácido sulfúrico (
), de concentración 0.250 mol/L, se necesita para neutralizar 45 mL de una solución acuosa de ácido sulfúrico (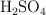 ) de concentración 0.5 eq-g/L?
) de concentración 0.5 eq-g/L?
-
Valoración de una solución de NaOH con biftalato de potasio (5179)
Se mide la masa y se disuelven en agua 0.2854 g de biftalato de potasio para estandarizar una solución de 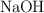 . Se realiza la titulación usando fenolftaleína como indicador y se consumen 15.5 mL de la solución de
. Se realiza la titulación usando fenolftaleína como indicador y se consumen 15.5 mL de la solución de 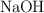 . ¿Cuál es la concentración de esta solución de
. ¿Cuál es la concentración de esta solución de 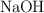 ?
?
-
Volumen de base necesario para neutralizar un ácido sulfúrico comercial (5147)
Si en la etiqueta de un ácido comercial especifica que contiene 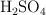 al
al 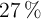 (m/V), con una densidad de 1.28 g/mL, ¿qué cantidad de
(m/V), con una densidad de 1.28 g/mL, ¿qué cantidad de 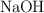 al 0.1 M es necesario para neutralizar 50 mL de la disolución comercial?
al 0.1 M es necesario para neutralizar 50 mL de la disolución comercial?
 Neutralización
Neutralización