-
Estequiometría de la combustión del alcohol etílico (4913)
Se dispone de 3.00 g de alcohol etílico y se queman, dándose la reacción:
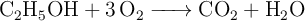
a) ¿Cuántos moles de 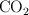 se producen cuando se queman los 3.00 g de
se producen cuando se queman los 3.00 g de 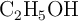 ?
?
b) ¿Qué volumen de 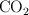 se obtendrá a una temperatura de
se obtendrá a una temperatura de 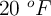 y 736 mm Hg?
y 736 mm Hg?
-
Reacción de formación del agua entre gases en distintas condiciones (4850)
Si tenemos 50 L de hidrógeno a 293 K y 2 atm y 30 L de oxígeno a 303 K y 3 atm, y los hacemos reaccionar para dar agua, ¿qué volumen de agua podremos obtener a 4 atm y 313 K? ¿Qué reactivo y en qué cantidad sobrará?
-
Volumen de disolución e hidrógeno producido en una reacción 0001
Se tratan de 45 g de zinc con una disolución 2 M de ácido clorhídrico. Calcula el volumen de hidrógeno desprendido, medido a 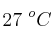 y 690 mm Hg, así como el volumen de disolución que se necesitará para ello, siendo la reacción:
y 690 mm Hg, así como el volumen de disolución que se necesitará para ello, siendo la reacción:
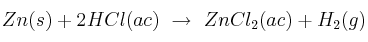
-
Cálculos sobre la reacción de formación del dióxido de azufre (4460)
Se hace reaccionar azufre con cantidad suficiente de oxígeno para obtener dióxido de azufre. Calcula qué masa de este óxido se puede obtener en los siguientes casos:
a) 3.5 moles de oxígeno.
b) 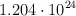 átomos de oxígeno.
átomos de oxígeno.
c) 12 moles de azufre.
d) 8 g de azufre.
e) 3.36 litros de oxígeno, medidos en condiciones normales.
-
Cálculos sobre la reacción de formación del dióxido de carbono 0001
Se desea obtener dióxido de carbono a partir de 30 g de carbono y con exceso de oxígeno. Calcula:
a) Los moles de oxígeno necesarios para la combustión completa.
b) Volumen de ese oxígeno si es medido en condiciones normales.
c) Masa de dióxido de carbono que se obtiene.
d) Número de moléculas de producto que se obtiene.
 Gases
Gases