-
Presión final para reducir a la mitad el volumen de un gas a temperatura constante (5717)
Un gas a temperatura constante, ocupa un volumen de 5 galones si la presión adquirida por el recipiente alcanza las 4 atm. Si su volumen se reduce a la mitad, ¿cuál sería la presión a la que estará sometido el gas?
-
Volumen final de un gas al variar P, T y V
Una muestra de 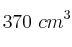 de oxígeno se recogió sobre agua a
de oxígeno se recogió sobre agua a 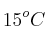 y una presión barométrica de 0,992 atm. ¿Qué volumen ocuparía esta muestra seca en condiciones normales de P y T?
y una presión barométrica de 0,992 atm. ¿Qué volumen ocuparía esta muestra seca en condiciones normales de P y T?
Datos: 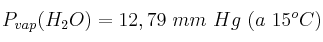
-
Volumen molar de un gas en ciertas condiciones de P y T (5661)
Calcula el volumen molar de un gas que se encuentra a 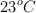 de temperatura y 8 atm de presión.
de temperatura y 8 atm de presión.
-
Moléculas de aire en un volumen en el que se hace vacío
¿Cuantas moléculas de aire estarán en un tanque de 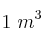 de volumen, si está a una presión de vacío de 150 micrones de mercurio y a una temperatura de
de volumen, si está a una presión de vacío de 150 micrones de mercurio y a una temperatura de 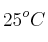 ?
?
-
Moles y masa de oxígeno introducidas en un cilindro (5610)
Un recipiente cilíndrico y vacío de 2.00 m de largo y 95.0 cm de diámetro se va a llenar con oxígeno puro a 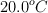 para almacenarse en una estación espacial. Para guardar tanto como sea posible, la presión absoluta del oxígeno será de
para almacenarse en una estación espacial. Para guardar tanto como sea posible, la presión absoluta del oxígeno será de 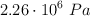 . La masa molar del oxígeno es 32.0 g/mol.
. La masa molar del oxígeno es 32.0 g/mol.
a) ¿Cuántos moles de oxígeno puede almacenar este recipiente?
b) Para alguien que levante este recipiente, ¿cuántos kilogramos aumenta este gas la masa que habrá de ser levantada?
 Leyes de los gases
Leyes de los gases