-
Cálculos sobre la reacción de formación del agua (4458)
5 L de hidrógeno, medidos en condiciones normales de presión y temperatura, reaccionan con cantidad suficiente de oxígeno para formar agua. Indica:
a) La ecuación química del proceso.
b) Los moles de agua que se obtienen.
c) Los litros de oxígeno, en las mismas condiciones, se necesitan.
-
Reacción entre gases con rendimiento de reacción (3743)
Industrialmente, el metanol se obtiene haciendo reaccionar monóxido de carbono e hidrógeno a elevadas presiones y temperaturas. Calcula la masa de metanol que se puede obtener a partir de los reactivos contenidos en un reactor de 50 L, a 100 atm de presión y 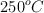 , si el rendimiento de la reacción es del
, si el rendimiento de la reacción es del 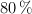 .
.
Dato: 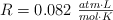
-
Combustión de metano: relación entre volúmenes 0001
En el proceso: 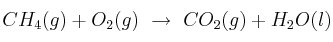
¿Cuál es el volumen, expresado en litros, de oxígeno que se requiere para hacer reaccionar 10 L de metano?
-
Estequiometría y presión parcial de un producto (3282)
Una muestra de 1.65 g de Al reacciona con HCl en exceso y el 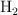 liberado se recoge sobre agua a
liberado se recoge sobre agua a  y a una presión barométrica de 744 mm Hg. ¿Cuál es el volumen total de
y a una presión barométrica de 744 mm Hg. ¿Cuál es el volumen total de 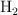 que se recoge, expresado en litros?
que se recoge, expresado en litros?
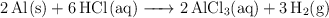
Dato: 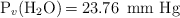 a
a 
-
Estequiometría aplicada a volumen en condiciones estándar 0001
¿Qué volumen de 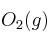 se consume en la combustión de 75,6 L de
se consume en la combustión de 75,6 L de 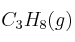 si se miden ambos gases en condiciones estándar?
si se miden ambos gases en condiciones estándar?
 Gases
Gases