-
Estequiometría: masa de producto a partir de masas de reactivos 0001
Para obtener dióxido de estaño se han hecho reaccionar 8,32 g de estaño con 2,51 g de oxígeno. ¿Qué cantidad de óxido se formará?
Datos: Sn = 118,7 ; O = 16
-
Estequiometría: reactivo limitante y rendimiento (2861)
Dada la siguiente reacción química, en la que se hacen reaccionar 36 g de 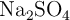 , con una pureza del
, con una pureza del 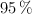 , y 27 g de
, y 27 g de 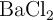 , con pureza del
, con pureza del 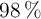 , y teniendo en cuenta que el rendimiento de la reacción es del
, y teniendo en cuenta que el rendimiento de la reacción es del 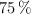 , calcula:
, calcula:

a) Ecuación balanceada.
b) El número de moles y gramos formados en la reacción.
Datos: Na = 23 ; Ba = 137.3 ; S = 32; O = 16 ; Cl = 35.5
-
Reacciones químicas: relación volumétrica 0001
La siguiente reacción ocurre a temperatura y presión constantes. Observa la ecuación:
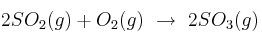
a) Determina cuántos litros de 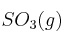 se forman cuando reaccionan 3 litros de oxígeno con suficiente cantidad de dióxido de azufre.
se forman cuando reaccionan 3 litros de oxígeno con suficiente cantidad de dióxido de azufre.
b) Si 3 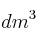 de dióxido de azufre reaccionan con 2
de dióxido de azufre reaccionan con 2 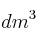 de oxígeno, ¿qué volumen de trióxido de azufre se forma?
de oxígeno, ¿qué volumen de trióxido de azufre se forma?
-
Combustión del amoniaco: ajuste y reactivo limitante 0001
El amoniaco (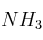 ) se quema para producir nitrógeno y agua:
) se quema para producir nitrógeno y agua:
a) Escribe y ajusta la reacción.
b) ¿Cuántos gramos de agua obtengo quemando 27 g de amoniaco?
c) Si quemo 20 g de amoniaco con 20 g de oxígeno, ¿cuántos gramos de nitrógeno obtengo?
-
Reacción química: ajuste, reactivo limitante y estequiometría (2853)
Disponemos, en un matraz, de 60 g de HCl a los que añadimos 30 g de 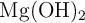 , produciéndose la siguiente reacción:
, produciéndose la siguiente reacción:
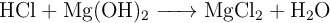
a) Ajusta la reacción.
b) ¿Qué reactivo se encuentra en exceso?
c) ¿Cuántos gramos de dicho reactivo permanecerán sin reaccionar al final del proceso?
d) ¿Cuántos gramos de 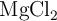 se producirán?
se producirán?
Masas atómicas: H = 1 ; Cl = 35.5 ; Mg = 24.3 ; O = 16
 Reactivo limitante
Reactivo limitante