-
EBAU Andalucía: química (junio 2010) - ejercicio B.6 (1045)
Para la reacción:
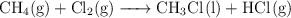
a) Calcula la entalpía de reacción estándar a 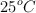 , a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
, a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
b) Sabiendo que el valor de 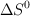 de la reacción es
de la reacción es 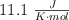 y utilizando el valor de
y utilizando el valor de 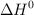 de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de
de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de 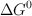 , a
, a 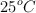 .
.
Datos: ![\Delta \ce{H_f^0[CH4(g)] = -74.8\ kJ/mol} \Delta \ce{H_f^0[CH4(g)] = -74.8\ kJ/mol}](local/cache-TeX/5a2baa76f1d353a3e96bf7eb166e82a8.png) ;
; ![\Delta \ce{H_f^0[CH3Cl(l)] = -82.0\ kJ/mol} \Delta \ce{H_f^0[CH3Cl(l)] = -82.0\ kJ/mol}](local/cache-TeX/ed5dbe6eed378fba7f6d6fb0a4219d10.png) ;
; ![\Delta \ce{H_f^0[HCl(g)] = -92.3\ kJ/mol} \Delta \ce{H_f^0[HCl(g)] = -92.3\ kJ/mol}](local/cache-TeX/08912cb4d9ce6868824a9dc378ece2e7.png) . Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
. Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.5 (1044)
En un recipiente de 1 litro de capacidad, en el que previamente se ha hecho el vacío, se introducen 0.1 mol de 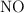 , 0.05 moles de
, 0.05 moles de 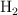 y 0.1 mol de agua. Se calienta el matraz y se establece el equilibrio:
y 0.1 mol de agua. Se calienta el matraz y se establece el equilibrio:

Sabiendo que cuando se establece el equilibrio la concentración de 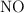 es 0.062 M, calcula:
es 0.062 M, calcula:
a) La concentración de todas las especies en el equilibrio.
b) El valor de la constante 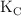 a esa temperatura.
a esa temperatura.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.4 (1043)
a) Ordena de menor a mayor acidez las disoluciones acuosas de igual concentración de 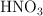 ,
, 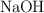 y
y 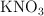 . Razona tu respuesta.
. Razona tu respuesta.
b) Se tiene un ácido fuerte HA en disolución acuosa. Justifica qué le sucederá al pH de la disolución al añadir agua.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.3 (1042)
a) Escribe la configuración electrónica de los iones 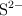 y
y 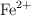 .
.
b) Indica un catión y un anión que sean isoelectrónicos con 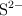 .
.
c) Justifica por qué la segunda energía de ionización del magnesio es mayor que la primera.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.2 (1041)
Un tubo de ensayo contiene 25 mL de agua. Calcula:
a) El número de moles de agua.
b) El número total de átomos de hidrógeno.
c) La masa en gramos de una molécula de agua.
Datos: Densidad del agua = 1 g/mL. Masas atómicas: O = 16; H = 1.
 EBAU
EBAU