-
Rendimiento teórico y volumen de gas que se obtiene en la reacción del NaCl con ácido sulfúrico (6179)
Se hicieron reaccionar 48.3 mg de NaCl con 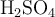 , formando la correspondiente sal y cloruro de hidrógeno. El gas fue recolectado alcanzando un volumen de
, formando la correspondiente sal y cloruro de hidrógeno. El gas fue recolectado alcanzando un volumen de 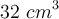 a una temperatura de
a una temperatura de 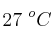 y una presión de 0.70 atm:
y una presión de 0.70 atm:
a) Escribe y balancea la ecuación que describe la reacción.
b) Calcula el rendimiento de la reacción.
c) Justifica el porcentaje de rendimiento obtenido.
d) Si se obtuviera un 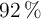 de rendimiento, ¿qué volumen ocuparía el gas?
de rendimiento, ¿qué volumen ocuparía el gas?
-
Reacción entre aluminio y oxígeno: ajuste y masa de oxígeno necesaria (6174)
El aluminio reacciona con oxígeno para formar óxido de aluminio (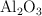 ).
).
a) Escribe la reacción e indica los reactivos y los productos.
b) Ajusta la reacción y explica la información que se obtiene de dicho ajuste.
c) ¿Qué cantidad de oxígeno será necesaria para obtener 10 moléculas de óxido de aluminio.
-
Masa de LiOH necesaria para eliminar el CO2 exhalado por tres astronautas (6154)
Los tres astronautas del Apolo 13, que fueron lanzados el 11 de abril y regresaron a la tierra el 17 de abril de 1970, se mantuvieron vivos durante su misión, en parte, por los recipientes de hidróxido de litio diseñados para eliminar del aire el 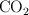 exhalado por los astronautas. El hidróxido de litio sólido reacciona con el
exhalado por los astronautas. El hidróxido de litio sólido reacciona con el 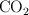 para formar carbonato de litio sólido y agua. Suponiendo que en un astronauta exhala 1.00 kg de
para formar carbonato de litio sólido y agua. Suponiendo que en un astronauta exhala 1.00 kg de 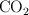 por día:
por día:
a) Plantea la ecuación quimica balanceada.
b) Determina los moles de 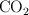 producidos en la exhalación de un día.
producidos en la exhalación de un día.
c) ¿Qué masa, expresada en gramos, de hidróxido de litio se requiere para eliminar todo el 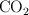 exhalado por los tres astronautas durante toda la misión?
exhalado por los tres astronautas durante toda la misión?
Masas atómicas en 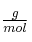 : Li = 7 ; O = 16 ; H = 1 ; C = 12.
: Li = 7 ; O = 16 ; H = 1 ; C = 12.
-
Reacción entre el dióxido de manganeso y el cloruro de hidrógeno (4744)
Al tratar una muestra de dióxido de manganeso con 20 g de cloruro de hidrógeno, se obtiene cloruro de manganeso(II), gas cloro y agua. Escribe y ajusta la reacción y calcula la masa de cloruro de manganeso(II) que se obtendrá.
Datos: Cl = 35.5 ; H = 1 ; Mn = 55.
-
Volumen de amoniaco al reaccionar 10 kg de nitrógeno (6149)
Una forma de sintetizar el gas amoniaco (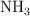 ) es combinando los gases nitrógeno y oxígeno a temperaturas y presiones extremadamente altas. Escribe la ecuación balanceada y calcula qué volumen de amoniaco se obtiene cuando 10 kg de nitrógeno se combinan con hidrógeno en exceso a
) es combinando los gases nitrógeno y oxígeno a temperaturas y presiones extremadamente altas. Escribe la ecuación balanceada y calcula qué volumen de amoniaco se obtiene cuando 10 kg de nitrógeno se combinan con hidrógeno en exceso a 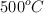 y 250 atm.
y 250 atm.
 Ajuste
Ajuste