-
Masa de oxígeno y productos para la combustión de una masa de butano (6618)
Determina la masa de oxígeno que reacciona con el butano de una botella de 13.4 kg así como las masas de dióxido de carbono y agua que se obtienen.
Masas atómicas: C = 12 ; H = 1 ; O = 16.
-
Reacción entre calcita y ácido sulfúrico (6609)
Una muestra de 15 g de calcita, que contiene un 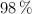 en peso de carbonato de calcio puro, se hace reaccionar con ácido sulfúrico del
en peso de carbonato de calcio puro, se hace reaccionar con ácido sulfúrico del 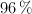 y densidad
y densidad 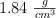 , formándose sulfato de calcio y desprendiéndose dióxido de carbono y agua.
, formándose sulfato de calcio y desprendiéndose dióxido de carbono y agua.
a) Formula y ajusta la reacción que tiene lugar.
b) ¿Qué volumen de ácido sulfúrico será necesario para que reaccione totalmente la muestra de calcita?
c) ¿Cuántos litros de  se desprenderán, medidos a 1 atm y
se desprenderán, medidos a 1 atm y  ?
?
d) ¿Cuántos gramos de sulfato de calcio se producirán en la reacción?
Datos. 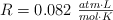 ; H = 1 ; C = 12 ; O = 16 ; S = 32 y Ca = 40.
; H = 1 ; C = 12 ; O = 16 ; S = 32 y Ca = 40.
-
Volumen de etanol que se obtiene al hacer reaccionar masas iguales de reactivos (6607)
El ácido etanoico 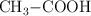 , se obtiene industrialmente por reacción del metanol con el monóxido de carbono:
, se obtiene industrialmente por reacción del metanol con el monóxido de carbono:
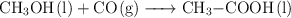
Calcula el volumen de disolución de ácido etanoico, del 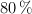 en masa y densidad 1.070 g/mL, que se podrá obtener al hacer reaccionar 20 kg de metanol con 20 kg de monóxido de carbono, si el rendimiento de la reacción es del
en masa y densidad 1.070 g/mL, que se podrá obtener al hacer reaccionar 20 kg de metanol con 20 kg de monóxido de carbono, si el rendimiento de la reacción es del 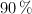 .
.
-
Obtención de propanona neutralizando ácido etanoico con hidróxido de calcio
Al neutralizar el ácido etanoico con hidróxido de calcio se obtiene etanoato de calcio, compuesto poco soluble en agua. Al calentar el etanoato de calcio se descompone y se obtiene carbonato de calcio, que es insoluble en agua, y propanona gaeosa, a partir de la cual se obtiene propanona líquida por condensación.
a) Escribe las ecuaciones químicas correspondientes a los procesos que han tenido lugar.
b) Calcula la masa de propanona que se podrá obtener a partir de 10 kg de un ácido etanoico al 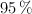 en masa, si el rendimiento de la operación global es del
en masa, si el rendimiento de la operación global es del 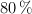 .
.
-
Volumen total de gases tras una combustión de etano y butano
Se tiene inicialmente una mezcla gaseosa formada por 0.50 L de etano, 2.5 L de butano y 20 L de oxígeno. Una vez los gases han reaccionado, calcula el volumen final, si todos los gases están medidos a iguales condiciones de presión y temperatura.
Nota: Considera el agua obtenida queda en estado gaseoso.
 Reacciones químicas
Reacciones químicas