-
Reactivo limitante 0001
¿Cuántos gramos de 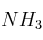 pueden preparase a partir de 85,5 g de
pueden preparase a partir de 85,5 g de 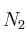 y 17,3 g de
y 17,3 g de 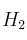 ?
?
-
Relación estequiométrica con volúmenes y reactivo limitante 0001
En la reacción de formación de amoniaco (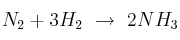 ), tenemos 50 litros de nitrógeno y 100 litros de hidrógeno,con P = 1 atm y T = 283 K. ¿Cuántos litros de amoniaco se obtienen?
), tenemos 50 litros de nitrógeno y 100 litros de hidrógeno,con P = 1 atm y T = 283 K. ¿Cuántos litros de amoniaco se obtienen?
-
Estequiometría y reactivo limitante de una reacción química (2216)
Si reaccionan 165 g de óxido de etileno 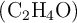 con 74 g de agua:
con 74 g de agua:
a) ¿Cuál es el reactivo en exceso?
b) ¿Qué moles y qué masa de este sobran?
-
Aplicación de estequiometría y reactivo limitante (2215)
Dada la ecuación química balanceada:
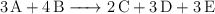
Sabiendo que las masas moleculares son: A = 100 u ; B = 150 u ; C = 85 u. Si reaccionan 100 g de A y 150 g de B, ¿cuántos moles y gramos de C se producirán?
-
Reacciones químicas: combustiones 0002
Se tiene una mezcla gaseosa formada por 1 litro de metano, 3 litros de etano y 15 litros de oxígeno. Una vez que los gases han reaccionado, calcula el volumen final de las sustancias existentes en el interior del recipiente si todos ellos están medidos en las mismas condiciones de presión y temperatura, (el agua que se forma se considera en estado gaseoso).
 Reactivo limitante
Reactivo limitante