-
Estudio de un equilibrio químico homogéneo (7864)
En un recipiente de 5 litros de capacidad se introducen 0.1 mol de una sustancia A, 0.1 mol de una sustancia B y 0.1 mol de otra C, todas ellas gaseosas. El sistema alcanza el equilibrio a la temperatura de 500 K, de acuerdo a la ecuación química:
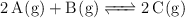
siendo entonces la presión en el recipiente de 2.38 atm. Se sabe que  está comprendida entre 100 y 150. Con estos datos:
está comprendida entre 100 y 150. Con estos datos:
a) Razona en qué sentido evolucionará la reacción hasta que alcance el equilibrio.
b) Calcula las concentraciones de cada especie en el equilibrio.
c) Determina el valor exacto de  .
.
d) ¿Cuál será la presión parcial de cada uno de los gases en el equilibrio?
e) Calcula el valor de  .
.
-
Presiones parciales de los reactivos de dos reacciones paralelas en el equilibrio (7827)
A temperaturas elevadas, el carbono y el dióxido de carbono reaccionan según la ecuación química en equilibrio:
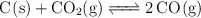
El carbonato de calcio también se descompone, a temperaturas elevadas, de acuerdo con la ecuación química:
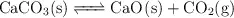
A 1 000 K, 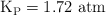 para la primera reacción, mientras que para la segunda reacción
para la primera reacción, mientras que para la segunda reacción 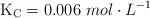 .
.
En un recipiente se introducen cantidades suficientes de carbono y de carbonato de calcio, ambos sólidos, se cierra herméticamente y se calientan hasta 1 000 K. Calcula, una vez establecido el equilibrio, las presiones parciales de cada uno de los gases presentes en el recipiente, la presión total a la que está sometido este y las concentraciones de todas las especies gaseosas.
Dato: El volumen ocupado por la mezcla de gases en equilibrio es de 10 litros.
-
EBAU Madrid: química (junio 2022) pregunta B.3 (7653)
El compuesto 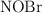 se descompone según la reacción:
se descompone según la reacción:
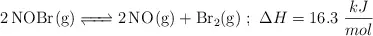
En un matraz de 1.0 L se introducen 2.0 mol de 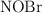 . Cuando se alcanza el equilibrio, a
. Cuando se alcanza el equilibrio, a  , se observa que se han formado 0.050 mol de
, se observa que se han formado 0.050 mol de 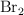 . Calcula:
. Calcula:
a) Las concentraciones de cada especie en el equilibrio.
b)  y
y  .
.
c) La presión total.
d) Justifica dos formas de favorecer la descomposición del 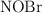 .
.
Dato: 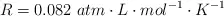
-
Concentración y masa inicial de un reactivo sabiendo la constante de equilbrio
En un recipiente de 5.00 L se introduce cloruro de amonio y se calientan a 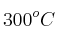 hasta que se alcanza el equilibrio, obteniendo como productos amoniaco y el ácido clorhídrico. Sabemos que en el equilibrio el amoniaco presenta una concentración de 0.92 mol/L y el ácido clorhídrico 1.40 mol/L. Si sabemos que
hasta que se alcanza el equilibrio, obteniendo como productos amoniaco y el ácido clorhídrico. Sabemos que en el equilibrio el amoniaco presenta una concentración de 0.92 mol/L y el ácido clorhídrico 1.40 mol/L. Si sabemos que 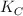 vale 0.0256:
vale 0.0256:
a) Plantea la ecuación química de la reacción en estudio.
b) Determina la concentración inicial y la cantidad química de cloruro de amonio de la cual se parte para que se dé la reacción.
-
Concentraciones en el equilibrio de la reacción entre nitrógeno y oxígeno
Para la ecuación química:
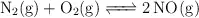
La constante de equilibrio 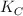 vale 0.00243 a 800 K. Si mezclamos 1.40 mol de
vale 0.00243 a 800 K. Si mezclamos 1.40 mol de 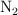 y 0.650 mol de
y 0.650 mol de  en un recipiente de 2.50 L a esa misma temperatura. Calcula la concentración para cada una de las especies en el equilibrio.
en un recipiente de 2.50 L a esa misma temperatura. Calcula la concentración para cada una de las especies en el equilibrio.
 Concentraciones
Concentraciones