-
Entropía y espontaneidad: selectividad junio 2012 0001
Dadas las siguientes ecuaciones termoquímicas:
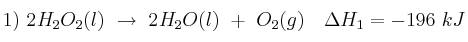
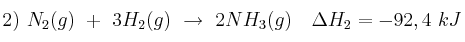
Justifica:
a) El signo que tendrá probablemente la variación de entropía en cada caso.
b) El proceso que será siempre espontáneo.
c) El proceso que dependerá de la temperatura para ser espontáneo.
-
Energía libre de Gibbs y espontaniedad (1614)
La entalpía de reacción estándar de la reacción entre el metano y el dicloro para dar clorometano y cloruro de hidrógeno es 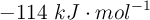 . Sabiendo que la variación de entropía estándar es
. Sabiendo que la variación de entropía estándar es 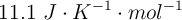 , calcula la variación de la energía libre de Gibbs estándar, a
, calcula la variación de la energía libre de Gibbs estándar, a 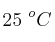 , y decide si el proceso el espontáneo o no en estas condiciones.
, y decide si el proceso el espontáneo o no en estas condiciones.
-
Cuestión termoquímica 0001
¿Puede ser espontánea una reacción endotérmica cuya variación de entropía sea positiva? ¿Por qué?
-
EBAU Andalucía: química (junio 2010) - ejercicio B.6 (1045)
Para la reacción:
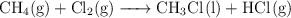
a) Calcula la entalpía de reacción estándar a  , a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
, a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
b) Sabiendo que el valor de 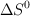 de la reacción es
de la reacción es 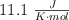 y utilizando el valor de
y utilizando el valor de 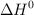 de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de
de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de 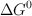 , a
, a  .
.
Datos: ![\Delta \ce{H_f^0[CH4(g)] = -74.8\ kJ/mol} \Delta \ce{H_f^0[CH4(g)] = -74.8\ kJ/mol}](local/cache-TeX/5a2baa76f1d353a3e96bf7eb166e82a8.png) ;
; ![\Delta \ce{H_f^0[CH3Cl(l)] = -82.0\ kJ/mol} \Delta \ce{H_f^0[CH3Cl(l)] = -82.0\ kJ/mol}](local/cache-TeX/ed5dbe6eed378fba7f6d6fb0a4219d10.png) ;
; ![\Delta \ce{H_f^0[HCl(g)] = -92.3\ kJ/mol} \Delta \ce{H_f^0[HCl(g)] = -92.3\ kJ/mol}](local/cache-TeX/08912cb4d9ce6868824a9dc378ece2e7.png) . Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
. Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
-
Problema de espontaniedad 0006
Calcula la variación de la energía libre de Gibbs de la combustión del metano en condiciones estándar y decide si es un proceso espontáneo.
Datos: 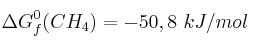 ;
; 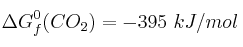 ;
; 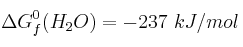 ;
; 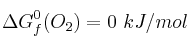
 Energía libre
Energía libre