-
Masa de HCl, moléculas y átomos de Cl en un volumen de disolución (6636)
En el laboratorio tenemos un ácido clorhídrico del 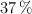 de riqueza en masa y
de riqueza en masa y 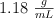 de densidad. Si cogemos 70 mL del contenido de esa botella, calcula:
de densidad. Si cogemos 70 mL del contenido de esa botella, calcula:
a) ¿Qué masa de ácido clorhídrico estaremos tomando?
b) ¿Cuántos moles son?
c) ¿Cuántas moléculas contiene? ¿Cuántos átomos de cloro hay?
-
Masa, moléculas y átomos de un compuesto químico (6514)
En un recipiente tengo 3.4 moles de moléculas de 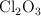 . Halla:
. Halla:
a) La masa de compuesto.
b) El número de moléculas contenidas.
c) El número de átomos de cloro.
Masas atómicas: Cl = 35.5 y O = 16.
-
Moles de níquel contenidos en una moneda (6443)
Si una moneda tiene una masa de 35 g y tiene una composición del 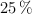 en masa en níquel. ¿Cuántos moles de níquel contiene?
en masa en níquel. ¿Cuántos moles de níquel contiene?
-
Refuerzo: entalpía de reacción como magnitud extensiva (6322)
Cuando se agregan 0.567 g de sodio metálico a un exceso de ácido clorhídrico, se produce un calor de 5 890 J. ¿Cuál es la entalpía de la reacción que se escribe a continuación?

La masa atómica del sodio es 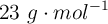 .
.
-
Masa de una molécula y de un mol de moléculas de flúor (6299)
Sabiendo que la masa de un átomo de flúor es 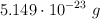 y que su molécula es tetraatómica, calcula:
y que su molécula es tetraatómica, calcula:
a) La masa de una molécula en gramos.
b) La masa de un mol de moléculas.
 Mol
Mol