-
Presiones parciales y presión total en la descomposición del fosgeno
Para el equilibrio:
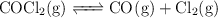
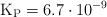 a determinada temperatura. Si al inicio la presión inicial del
a determinada temperatura. Si al inicio la presión inicial del 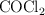 puro es 0.87 atm:
puro es 0.87 atm:
a) ¿Cuáles serán las presiones parciales en el equilibrio de 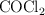 ,
, 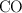 y
y 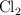 ?
?
b) ¿Cuál será la presión total en el equilibrio?
-
Equilibrio químico Opción A EBAU Andalucía junio 2017
Para el equilibrio: 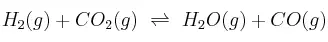 , la constante
, la constante  es 4,40 a 200 K. Calcula:
es 4,40 a 200 K. Calcula:
a) Las concentraciones en el equilibrio cuando se introducen simultáneamente 1 mol de 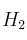 y 1 mol de
y 1 mol de  en un reactor de 4,68 L a dicha temperatura.
en un reactor de 4,68 L a dicha temperatura.
b) La presión parcial de cada especie en el equilibrio y el valor de  .
.
Dato: 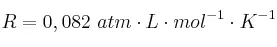
-
Cálculo de presiones parciales y Kc y Kp (2385)
Tenemos el siguiente equilibrio gaseoso a 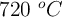 :
:
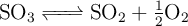
A una presión de 0.25 atm, el 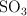 se encuentra disociado en un
se encuentra disociado en un 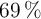 . Calcula las presiones parciales de cada gas en el equilibrio y los valores de
. Calcula las presiones parciales de cada gas en el equilibrio y los valores de  y
y  .
.
-
Presiones parciales y constante de equilibrio 0001
A 25 °C la descomposición del tetraóxido de dinitrógeno:
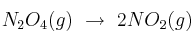
tiene una constante de equilibrio 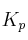 de 0,144. En el equilibrio, la presión total del sistema es 0,48 atmósferas. ¿Cuál es la presión parcial de cada gas en equilibrio?
de 0,144. En el equilibrio, la presión total del sistema es 0,48 atmósferas. ¿Cuál es la presión parcial de cada gas en equilibrio?
-
Constante de equilibrio y presiones parciales 0001
A 523 K las concentraciones de 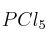 ,
, 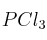 y
y 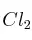 en equilibrio para la reacción:
en equilibrio para la reacción:
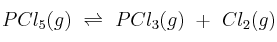
son 0,809 M, 0,190 M y 0,190 M, respectivamente. Calcule a esa temperatura:
a) Las presiones parciales de las tres especies en el equilibrio.
b) La constante  de la reacción.
de la reacción.
 Presión parcial
Presión parcial