-
pH final de una mezcla de disoluciones de HCl y NH3 (5471)
¿Qué pH tendrá una disolución de 20.0 mL de HCl de concentración 0.5 M a la que se le añaden 60.0 mL de 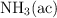 de 0.5 M de concentración?
de 0.5 M de concentración?
Dato: 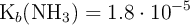
-
Concentraciones en el equilibrio de todas las especies en una disolución de ácido clórico (5107)
En condiciones ambientales normales, 1 atm y 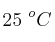 , se tiene 1 litro de agua (
, se tiene 1 litro de agua (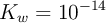 ), de densidad 1 g/mL. Se le agregan 3 moles de ácido clórico, considerando que no varía el volumen, con (
), de densidad 1 g/mL. Se le agregan 3 moles de ácido clórico, considerando que no varía el volumen, con (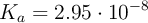 ). Considerando que la concentración de los protones en el sistema depende significativamente del ácido, es decir, ignorando lo que el agua pueda o no aportar, calcula las concentraciones molares de todas las especies:
). Considerando que la concentración de los protones en el sistema depende significativamente del ácido, es decir, ignorando lo que el agua pueda o no aportar, calcula las concentraciones molares de todas las especies: 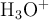 ,
, 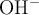 ,
, 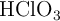 y
y 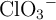 .
.
-
pH de una taza de café
La concentración de iones ![[OH^-] [OH^-]](local/cache-TeX/38fd0dbf794f97d049e4f0e8bc6351bf.png) en una taza de café es igual a
en una taza de café es igual a 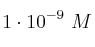 . Calcula su pH.
. Calcula su pH.
-
PAU junio 2014: verdadero/falso sobre ácido-base
Indica, razonadamente, si cada una de las siguientes proposiciones es verdadera o falsa:
a) De acuerdo con la teoría de Brönsted-Lowry el carácter básico del amoniaco, en disoluciones acuosas, se debe a que acepta un grupo 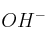 de la molécula de agua.
de la molécula de agua.
b) Si el pH de una disolución de un ácido monoprótico fuerte es 2,17 la concentración molar de la disolución respecto a dicho ácido estará comprendida entre 0,001 y 0,01.
c) En disoluciones acuosas, el ion 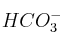 se comporta como un electrolito anfótero.
se comporta como un electrolito anfótero.
-
Concentración de especies en el equilibrio de disociación del ácido nitroso (2602)
Si tiene una disolución de ácido nitroso (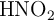 ), cuya concentración inicial es 0.003 M y la constante de disociación es igual a
), cuya concentración inicial es 0.003 M y la constante de disociación es igual a 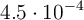 , ¿cuál será la concentración de las especies en el equilibrio?
, ¿cuál será la concentración de las especies en el equilibrio?
 Ionización
Ionización