-
Electrolisis de nitrato de plata: concentración y neutralización de iones resultantes (5338)
Se lleva a cabo la electrolisis de 3 L de disolución acuosa de nitrato de plata (0.25 M) haciendo circular una corriente de 6 A. Sabiendo que el rendimiento del proceso es del 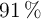 :
:
a) Escribe las semirreacciones que se llevan a cabo y realiza un esquema del proceso electrolítico, indicado la polaridad de los electrodos y la marcha de los electrones.
b) Calcula el tiempo que se hizo circular la corriente eléctrica mencionada, sabiendo que se depositaron 3.85 g del metal.
c) Calcula la concentración de todos los iones que quedan en disolución después del proceso de electrolisis.
d) Calcula el volumen de hidróxido de calcio 0.5 M o de ácido clorhídrico 0.4 M que habría que habría que agregar al finalizar la electrolisis para que el pH de la disolución resulte neutro.
-
Masa de magnesio que se deposita en el cátodo tras pasar una corriente (5257)
¿Cuántos gramos de magnesio serán depositados en el cátodo por una corriente de 4.8 A al pasar por una solución de sulfato de magnesio durante una hora?
-
Equivalente electroquímico de un catión
Calcula el equivalente electroquímico del sulfato de estaño(IV).
-
PAU Andalucía junio 2014: electroquímica y ley de Faraday
a) ¿Qué cantidad de electricidad es necesaria para que se deposite en el cátodo todo el oro contenido en un litro de disolución 0,1 M de cloruro de oro(III)?
b) ¿Qué volumen de dicloro, medido a una presión de 740 mm Hg y 25 ºC , se desprenderá del ánodo?
Datos: F = 96 500 C; 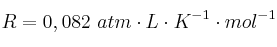 ; Au = 197; Cl: 35,5
; Au = 197; Cl: 35,5
-
Ley de Faraday 0001
¿Cuanto tiempo llevará el depositarse 100 g de aluminio con una corriente de 125 amperios?
 Electroquímica
Electroquímica