-
Masa y moles de una muestra de una mezcla de gases (6830)
Se ha obtenido una muestra de gas de un pozo y se ha comprobado que, a 1.0 atm y  , está formada por 4.0 L de
, está formada por 4.0 L de 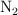 , 5.0 L de
, 5.0 L de 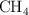 y 11.0 L de
y 11.0 L de  . Calcula:
. Calcula:
a) La cantidad de sustancia (mol) y la masa (g) de cada uno.
b) Las fracciones molares y las presiones parciales si comprimimos el gas hasta 2.0 atm.
-
Molaridad, molalidad y fracción molar en una disolución de sacarosa (6708)
Una disolución acuosa de sacarosa, de 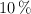 en masa, tiene una densidad de
en masa, tiene una densidad de 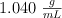 . ¿Cuál es la molaridad, la molalidad, y la fracción molar de la sacarosa en esta disolución?
. ¿Cuál es la molaridad, la molalidad, y la fracción molar de la sacarosa en esta disolución?
Masa molar de la sacarosa: 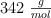 .
.
-
Fracción molar de ácido sulfúrico sabiendo la molaridad y densidad (6430)
Determina la fracción molar del soluto y solvente de 2 L de solución 3 M de ácido sulfúrico, cuya densidad es 1.12 g/mL.
Masas atómicas: S = 32 ; O = 16 ; H = 1.
-
Fracción molar de amoniaco a partir de molaridad y densidad (6412)
Para una práctica de laboratorio se utilizó amoniaco con una concentración de 14.8 M y una densidad de 0.898 g/mL. ¿Cuáles son las fracciones másica y molar del amoniaco en esta disolución?
-
Ampliación: gases, presiones parciales y composición
Una mezcla de gases tiene la siguiente composición centesimal en masa:
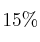 de
de 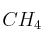 ,
, 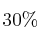 de
de  ,
, 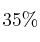 de
de 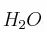 ,
, 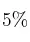 de
de 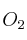 y
y 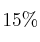 de
de 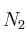 . La mezcla se encuentra a una presión de
. La mezcla se encuentra a una presión de 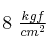 y una temperatura de
y una temperatura de  , ocupando un volumen de 500 L. Calcula:
, ocupando un volumen de 500 L. Calcula:
a) Las presiones parciales expresadas en 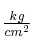 .
.
b) Las presiones parciales expresadas en atm.
c) La composición centesimal en moles de la mezcla.
d) Las masas de cada componente en kg.
 Fracción molar
Fracción molar