-
Cantidad de acético producido y rendimiento de la reacción (6890)
El ácido acético (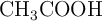 ) se obtiene mediante la reacción entre el metanol (
) se obtiene mediante la reacción entre el metanol (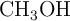 ) y el monóxido de carbono (
) y el monóxido de carbono (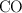 ), en presencia de un catalizador. Se realiza una prueba experimental partiendo de 15 g de metanol y 10 g de óxido de carbono. Calcula:
), en presencia de un catalizador. Se realiza una prueba experimental partiendo de 15 g de metanol y 10 g de óxido de carbono. Calcula:
a) La cantidad de ácido acético que deberíamos obtener.
b) Si realmente se han producido 19.1 g de ácido acético, ¿cuál es el rendimiento de la reacción?
Masas atómicas: C: 12.01; H: 1.01; O: 16.00.
-
Obtención de propanona neutralizando ácido etanoico con hidróxido de calcio
Al neutralizar el ácido etanoico con hidróxido de calcio se obtiene etanoato de calcio, compuesto poco soluble en agua. Al calentar el etanoato de calcio se descompone y se obtiene carbonato de calcio, que es insoluble en agua, y propanona gaeosa, a partir de la cual se obtiene propanona líquida por condensación.
a) Escribe las ecuaciones químicas correspondientes a los procesos que han tenido lugar.
b) Calcula la masa de propanona que se podrá obtener a partir de 10 kg de un ácido etanoico al 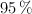 en masa, si el rendimiento de la operación global es del
en masa, si el rendimiento de la operación global es del 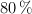 .
.
-
Reacciones químicas: reactivo limitante, impurezas y rendimiento de reacción (6294)
En el laboratorio se puede producir 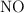 gaseoso haciendo reaccionar cobre metálico con ácido nítrico diluido, según la siguiente ecuación química:
gaseoso haciendo reaccionar cobre metálico con ácido nítrico diluido, según la siguiente ecuación química:
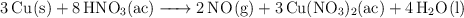
a) Indica cuál es el agente oxidante en esta reacción redox.
b) ¿Qué volumen de ese gas, a 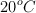 y 750 mm Hg, se puede preparar a partir de 35 g de cobre y 0.6 moles de ácido nítrico? Considera comportamiento de gas ideal para el óxido de nitrógeno.
y 750 mm Hg, se puede preparar a partir de 35 g de cobre y 0.6 moles de ácido nítrico? Considera comportamiento de gas ideal para el óxido de nitrógeno.
c) ¿Cuál sería ese volumen si el cobre a emplear contuviera un 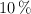 en peso de impurezas no reactivas y se supiera que el rendimiento máximo de la técnica es del
en peso de impurezas no reactivas y se supiera que el rendimiento máximo de la técnica es del 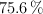 ?
?
Datos: Cu = 63.5 ; 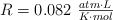
-
Rendimiento teórico y volumen de gas que se obtiene en la reacción del NaCl con ácido sulfúrico (6179)
Se hicieron reaccionar 48.3 mg de NaCl con 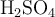 , formando la correspondiente sal y cloruro de hidrógeno. El gas fue recolectado alcanzando un volumen de
, formando la correspondiente sal y cloruro de hidrógeno. El gas fue recolectado alcanzando un volumen de 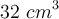 a una temperatura de
a una temperatura de 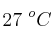 y una presión de 0.70 atm:
y una presión de 0.70 atm:
a) Escribe y balancea la ecuación que describe la reacción.
b) Calcula el rendimiento de la reacción.
c) Justifica el porcentaje de rendimiento obtenido.
d) Si se obtuviera un 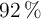 de rendimiento, ¿qué volumen ocuparía el gas?
de rendimiento, ¿qué volumen ocuparía el gas?
-
Rendimiento de la reacción entre yodato de potasio e hidracina
El yodato de potasio sólido (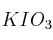 ), reacciona con la hidracina líquida (
), reacciona con la hidracina líquida (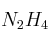 ), para dar:
), para dar:
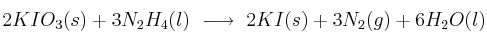
Si se someten a reacción 500 g de yoduro de potasio con 200 g de hidracina, determina:
a) La masa sobrante del reactivo en exceso.
b) La masa de yoduro de potasio (KI), que se forma con 100 g de 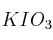 y un exceso de
y un exceso de 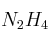 .
.
c) El rendimiento de la reacción, si al reaccionar 15.1 g de 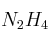 y un exceso de
y un exceso de 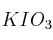 , se obtienen experimentalmente 35.50 g de KI.
, se obtienen experimentalmente 35.50 g de KI.
Masas atómicas: I = 127 u ; N = 14 u ; H = 1 u ; O = 16 u ; K = 39 u.
 Rendimiento
Rendimiento