-
EBAU Madrid: química (junio 2022) pregunta A.4 (7633)
La reacción  es de primer orden con respecto a
es de primer orden con respecto a 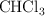 y de orden
y de orden 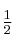 con respecto a
con respecto a 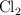 .
.
a) Escribe la ecuación de velocidad y determina el orden total de la reacción.
b) Deduce la unidades de la constante de velocidad.
c) Justifica cómo afecta a la velocidad de reacción un aumento de volumen a temperatura constante.
d) Justifica cómo afecta a la velocidad de reacción un aumento de la temperatura.
-
Obtención gráfica de la cinética de la descomposición del agua oxigenada gráficamente (7257)
Se estudió a  la descomposición de agua oxigenada en solución acuosa en presencia de catalasa. Para este estudio se tomaron muestras a distintos intervalos y se valoró la concentración de agua oxigenada con permanganato de potasio en medio ácido. Se obtuvieron los siguientes resultados:
la descomposición de agua oxigenada en solución acuosa en presencia de catalasa. Para este estudio se tomaron muestras a distintos intervalos y se valoró la concentración de agua oxigenada con permanganato de potasio en medio ácido. Se obtuvieron los siguientes resultados:
![\begin{tabular}{|c|c|} \hline t\ (min) & [\ce{H2O2}]\cdot 10^3\ (\text{M})\\ \hline 0 & 46.0\\ \hline 5 & 37.1\\ \hline 10 & 30.0\\ \hline 20 & 19.6\\ \hline 30 & 12.3\\ \hline 50 & 5.00\\ \hline \end{tabular} \begin{tabular}{|c|c|} \hline t\ (min) & [\ce{H2O2}]\cdot 10^3\ (\text{M})\\ \hline 0 & 46.0\\ \hline 5 & 37.1\\ \hline 10 & 30.0\\ \hline 20 & 19.6\\ \hline 30 & 12.3\\ \hline 50 & 5.00\\ \hline \end{tabular}](local/cache-TeX/6fdb6a479f028e4aff7c1e65535e787d.png)
a) Determina gráficamente el orden de la reacción y calcula el valor de la constante de velocidad y el tiempo de vida media.
b) Escribe las ecuaciones de la valoración balanceadas. Si la valoración se hizo sobre una alícuota de 25 mL y con una solución de permanganato de potasio, preparada disolviendo 2.8 g de sal en 500 mL de solución, calcula cuántos mL de solución de permanganato de potasio se gastaron a los tiempos 0 y 20 minutos.
-
Concentración al cabo de un tiempo para una reacción de segundo orden (6482)
Si el tiempo de vida media de una reacción de segundo orden es 60.0 s, y la concentración inicial es 0.800 M, ¿cuál era la concentración a los 20.0 s?
-
Concentración conocido su orden de reacción y tiempo de semirreacción (6481)
Si el tiempo de vida media de una reacción de primer orden es 25.0 s, ¿cuál era la concentración cuando habían transcurrido 8.00 s si la concentración inicial era de 0.500 M?
-
Energía de activación de una reacción de orden uno y constante de velocidad (6164)
Para la reacción irreversible de primer orden:
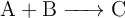
se sabe que la velocidad se hace cuatro veces mayor cuando aumenta la temperatura de 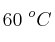 a
a 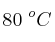 . Teniendo en cuenta que la constante de velocidad a
. Teniendo en cuenta que la constante de velocidad a 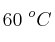 para dicha reacción es
para dicha reacción es 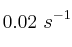 , determina:
, determina:
a) La energía de activación de la reacción (expresada en kJ/mol).
b) La constante de velocidad cuando la reacción se lleva a cabo a 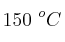 .
.
 Constante velocidad
Constante velocidad