-
Propiedades periódicas: orden creciente de algunas de ellas (1568)
Dados los elementos Br, C, Cu y Li, ordénalos de forma creciente según: a) su radio atómico; b) su energía de ionización y c) su electronegatividad.
-
Configuración electrónica y propiedades periódicas 0002
a) Dos átomos tienen las siguientes configuraciones electrónicas 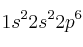 y
y 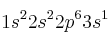 . La primera energía de ionización de uno es 2080 kJ/mol y la del otro 496 kJ/mol. Asigne cada uno de estos valores a cada una de las configuraciones electrónicas y justifique la elección.
. La primera energía de ionización de uno es 2080 kJ/mol y la del otro 496 kJ/mol. Asigne cada uno de estos valores a cada una de las configuraciones electrónicas y justifique la elección.
b) La segunda energía de ionización del átomo de helio ¿será mayor, menor o igual que la energía de ionización del átomo de hidrógeno? Razone la respuesta.
-
EBAU Andalucía: química (junio 2011) - ejercicio A.2 (1460)
a) Escribe las configuraciones electrónicas de los átomos Na y Mg.
b) Justifica por qué el valor de la primera energía de ionización es mayor para el magnesio que para el sodio.
c) Justifica por qué el valor de la segunda energía de ionización es mayor para el átomo de sodio que para el de magnesio.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.3 (1042)
a) Escribe la configuración electrónica de los iones 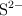 y
y 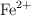 .
.
b) Indica un catión y un anión que sean isoelectrónicos con 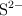 .
.
c) Justifica por qué la segunda energía de ionización del magnesio es mayor que la primera.
-
PAU enlace iónico 0006
Los números atómicos de los elementos A, B y C son 11, 17 y 20.
a) Escribe la configuración electrónica de cada uno y escribe su símbolo, periodo y grupo al que pertenece.
b) ¿Cuáles serán los estados de oxidación más probables para cada uno?
c) Si comparamos A y B, ¿cuál es el más electronegativo? ¿Cuál tiene menor energía de ionización?
d) Explica qué tipo de enlace se podrá formar entre B y C y cuál será la fórmula empírica del compuesto.
 Energía ionización
Energía ionización