-
PAU ley de Hess 0001
a) Escribe las ecuaciones de combustión del ácido butanoico, el hidrógeno y el carbón.
b) Indica cuáles de los reactivos o productos de esas reacciones tienen una entalpía de formación nula en condiciones estándar.
c) Aplicando la ley de Hess, explica cómo calcularías la entalpía de formación del ácido butanoico a partir de las entalpías de combustión de las reacciones del apartado a).
-
PAU: Entalpía de formación del sulfuro de carbono a partir de la entalpía de reacción (525)
El sulfuro de carbono reacciona con el oxígeno según:
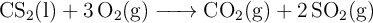
Sabiendo que su 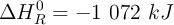 :
:
a) Calcula la entalpía de formación del 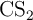 .
.
b) Halla el volumen de 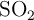 emitido a la atmósfera, a 1 atm y 298 K, cuando se ha liberado una energía de 6 000 kJ.
emitido a la atmósfera, a 1 atm y 298 K, cuando se ha liberado una energía de 6 000 kJ.
Datos (en kJ/mol): ![\Delta H^0_f[\ce{CO2(g)}] = -393.5 \Delta H^0_f[\ce{CO2(g)}] = -393.5](local/cache-TeX/7e0d44d6a1674172826c47cfe25bfdfe.png) ;
; ![\Delta H^0_f[\ce{SO2(g)}] = -296.4 \Delta H^0_f[\ce{SO2(g)}] = -296.4](local/cache-TeX/63e3d374f480aac1e913a3116dd07cce.png)
-
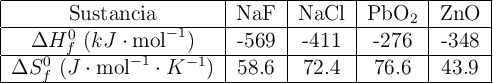
Variación de la energía libre de Gibbs para dos reacciones (521)
Calcula el incremento de energía libre estándar para las siguientes reacciones:

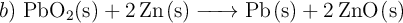
Comenta qué piensas sobre la posibilidad de utilizar estas reacciones en la obtención de flúor y plomo respectivamente. Datos:
-
Determinación de la espontaneidad de la descomposición del monóxido de nitrógeno (520)
La descomposición del monóxido de nitrógeno transcurre según:
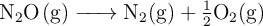
Siendo 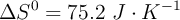 y
y 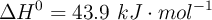 .
.
a) ¿Es la reacción espontánea en condiciones estándar?
b) ¿A partir de qué temperatura será espontánea?
-
Variación de entropía para la descomposición del amoniaco (519)
Calcula la variación de entropía, en condiciones estándar, para el proceso de descomposición del amoniaco.
Datos en 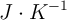 :
: 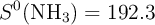 ;
; 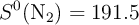 ;
; 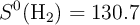
 RESUELTO
RESUELTO