-
Calor liberado al quemar 2 L de metano (452)
Determina el calor que se liberará al quemarse 2 litros de metano medidos a  y 1 atm de presión, sabiendo que la
y 1 atm de presión, sabiendo que la 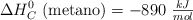 .
.
-
Variación de energía interna en la combustión del butano (451)
Determina la variación de energía interna correspondiente al proceso de combustión estándar del butano, si la entalpía correspondiente a este proceso vale 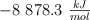 .
.
Dato: 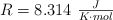 .
.
-
Calor a presión y volumen constante en distintas reacciones químicas (450)
Para cada una de las siguientes reacciones, explica si el calor desprendido a presión constante (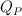 ) es menor, mayor o igual que el calor desprendido a volumen constante (
) es menor, mayor o igual que el calor desprendido a volumen constante (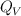 ):
):
a) 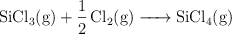
b) 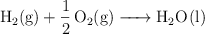
c) 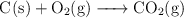
-
Problema de aplicación de la primera ley de la termodinámica (449)
Una muestra de 2.120 g de octano se quema en una bomba calorimétrica a volumen constante y se desprenden 101.47 kJ. Calcula la variación de energía interna y de entalpía en el proceso de combustión de un mol de octano, teniendo en cuenta que la temperatura de trabajo es de 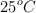 y la presión de una atmósfera.
y la presión de una atmósfera.
-
Calores de combustión y composición centesimal de una mezcla de etano y propano (274)
Un proceso industrial necesita 36 200 kJ que se obtienen quemando, en condiciones estándar, 422 L de una mezcla de etano y propano. Calcula:
a) El calor de combustión del etano y del propano.
b) La composición molar, en porcentaje, del gas utilizado.
Datos en kJ/mol:
![\Delta H_f^0[\text{etano(g)}] = -85 \Delta H_f^0[\text{etano(g)}] = -85](local/cache-TeX/55be98e21480bc1c7ffacfe524637b25.png) ;
; ![\Delta H_f^0[\text{propano(g)}] = -104 \Delta H_f^0[\text{propano(g)}] = -104](local/cache-TeX/d4792f29755d53a7df7657249bdea7ba.png) ;
; ![\Delta H_f^0[\ce{CO2(g)}] = -394 \Delta H_f^0[\ce{CO2(g)}] = -394](local/cache-TeX/2240e7b55bf80a263961731fc5888f3d.png) ;
; ![\Delta H_f^0[\ce{H2O(l)}] = -286 \Delta H_f^0[\ce{H2O(l)}] = -286](local/cache-TeX/43d1a8d50f260904622cf81acf0e3fa1.png)
 Entalpía
Entalpía