-
Reactivo limitante, reactivo sobrante y masa de producto (929)
En un reactor se introducen 76.2 g de 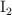 y 9.94 L de
y 9.94 L de 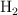 , medidos a 1 atm y
, medidos a 1 atm y 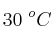 . Determina:
. Determina:
a) ¿Cuál es el reactivo limitante?
b) ¿Qué cantidad del otro reactivo queda sin reaccionar?
c) ¿Qué masa de HI se produce en la reacción?
Datos: H = 1 ; I = 127 ; 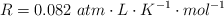
-
Combustión de la hidracina y productos obtenidos (923)
La hidracina, 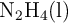 , es un combustible usado en la propulsión de vehículos espaciales. Cuando se combina con oxígeno,
, es un combustible usado en la propulsión de vehículos espaciales. Cuando se combina con oxígeno, 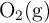 , se obtiene nitrógeno gaseoso y agua.
, se obtiene nitrógeno gaseoso y agua.
a) Escribe la ecuación química.
b) Calcula el volumen de nitrógeno obtenido, en condiciones normales, si se queman 120 g de hidracina y la cantidad de agua generada.
c) Determina el número de moléculas de oxígeno necesarias para llevar a cabo la combustión.
Datos: N = 14 ; O = 16 ; H = 1
-
Estequiometría de la reacción de descomposición del ácido nítrico (872)
El ácido nítrico se descompone, por acción de la luz, en dióxido de nitrógeno, oxígeno (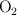 ) y agua. Si se obtienen 40.5 g de agua en la descomposición:
) y agua. Si se obtienen 40.5 g de agua en la descomposición:
a) ¿Qué cantidad de ácido habrá reaccionado?
b) ¿Cuántos moles de dióxido de nitrógeno y oxígeno se obtienen?
c) ¿Qué volumen ocupa la mezcla de gases anterior en condiciones estándar (1 atm y 298 K)?
-
Reacción de oxidación del dióxido de azufre (841)
El dióxido de azufre ( ) se oxida con el oxígeno del aire para formar el trióxido de azufre (
) se oxida con el oxígeno del aire para formar el trióxido de azufre (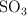 ). Suponiendo que la reacción tiene lugar en condiciones estándar (1 atm y 298 K), ¿qué volumen de
). Suponiendo que la reacción tiene lugar en condiciones estándar (1 atm y 298 K), ¿qué volumen de 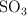 se obtendría si reaccionan 2.5 kg de
se obtendría si reaccionan 2.5 kg de  con exceso de oxígeno?
con exceso de oxígeno?
Datos: S = 32 ; O = 16.
-
Descomposición térmica del clorato de potasio (840)
El clorato potásico se descompone térmicamente según la reacción:
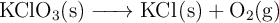
Si se calientan 15 g de 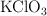 . Calcula:
. Calcula:
a) ¿Qué masa de KCl se obtendrá?
b) ¿Qué masa de oxígeno,  ?
?
c) ¿Qué volumen de oxígeno, medido en condiciones normales?
(Datos: K = 39 ; Cl = 35.5 ; O = 16)
 Gases
Gases