-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio C.2 (8243)
Para la siguiente reacción:

Calcula:
a) La entalpía de reacción estándar.
b) La variación de energía interna (calor a volumen constante) a 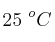 .
.
Datos: 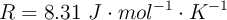
-
Longitud de onda de un fotón para que pueda disociar una molécula de nitrógeno (8075)
Calcula la longitud de onda máxima de un fotón que pueda producir la reacción:
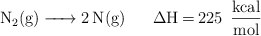
Datos: 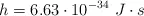 ;
; 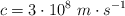
-
Energía de un enlace de hidrógeno y porcentaje de enlaces que se rompen (7374)
a) El calor de sublimación para una forma hipotética del agua en la que no hay puentes de hidrógeno es de 2.6 kcal/mol. Si el calor de sublimación observado en el agua es de 12.2 kcal/mol, ¿cuál es la energía de un enlace de hidrógeno?
b) El calor de fusión del hielo es 1.4 kcal/mol y el de la forma hipotética en la que no se forman puentes de hidrógeno es de 0.30 kcal/mol. Calcula el porcentaje de puentes de hidrógeno que se rompen. Recuerda que cada molécula de agua puede formar dos puentes de hidrógeno.
-
Selectividad septiembre 2012: Energía de enlace y energía interna 0001
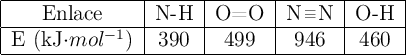
a) Calcula la variación de entalpía de formación del amoniaco, a partir de los siguientes datos de energías de enlace: E (H-H) = 436 kJ/mol; E (N-H) = 389 kJ/mol; E (N≡N) = 945 kJ/mol.
b) Calcula la variación de energía interna en la formación del amoniaco a la temperatura de 25 ºC.
Dato: R=8,31 J·K-1·mol-1.
-
Entalpías de formación, reacción y enlace 0001
La reacción de hidrogenación del buta-1,3-dieno para dar butano es 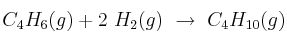 . Calcula la entalpía de la reacción a 25 ºC y en condiciones estándar:
. Calcula la entalpía de la reacción a 25 ºC y en condiciones estándar:
a) A partir de la entalpía de formación del agua y de las entalpías de combustión del buta-1,3-dieno y del butano.
b) A partir de las entalpías de enlace.
Datos: ![\Delta H_C^0[C_4H_6(g)] = -2540,2\ kJ/mol \Delta H_C^0[C_4H_6(g)] = -2540,2\ kJ/mol](local/cache-TeX/8def700d5e629e0012f77d6d53d85868.png) ;
; ![\Delta H_C^0[C_4H_{10}(g)] = -2877,6\ kJ/mol \Delta H_C^0[C_4H_{10}(g)] = -2877,6\ kJ/mol](local/cache-TeX/7c3b4856f15a580f055b64f06c3d1aad.png) ;
; ![\Delta H_f^0[H_2O(l)] = -285,6\ kJ/mol \Delta H_f^0[H_2O(l)] = -285,6\ kJ/mol](local/cache-TeX/ab792c53203f068d97f6bbb9308c00b3.png) . Entalpías de enlace (kJ/mol): (C-C) = 348,2 ; (C=C) = 612,9 ; (C-H) = 415,3 ; (H-H) = 436,4.
. Entalpías de enlace (kJ/mol): (C-C) = 348,2 ; (C=C) = 612,9 ; (C-H) = 415,3 ; (H-H) = 436,4.
 Energía de enlace
Energía de enlace