-
Modelo de colisiones: ¿cuándo son efectivos los choques? (8210)
En la reacción entre las sustancias X e Y se aprecia que algunos de los choques entre las partículas de X y las de Y no dan lugar a productos. ¿Cuál es la afirmación más adecuada para explicarlo?
a) El sistema ya ha alcanzado el equilibrio.
b) La energía de activación de la reacción inversa es muy baja.
c) Las partículas de X e Y no colisionan con la debida orientación.
d) El «complejo activado» es muy inestable.
-
Variación de la velocidad de reacción al variar el volumen (8208)
Para la reacción en fase gaseosa  , la ecuación de velocidad es:
, la ecuación de velocidad es:
![v = k[A]^2[B] v = k[A]^2[B]](local/cache-TeX/8d19e2970fb490420ea2192fcac2af92.png)
¿Cuál será el factor de aumento de velocidad si el volumen se reduce cuatro veces?
-
EBAU Madrid: química (junio 2022) pregunta A.4 (7633)
La reacción  es de primer orden con respecto a
es de primer orden con respecto a 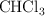 y de orden
y de orden 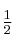 con respecto a
con respecto a 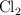 .
.
a) Escribe la ecuación de velocidad y determina el orden total de la reacción.
b) Deduce la unidades de la constante de velocidad.
c) Justifica cómo afecta a la velocidad de reacción un aumento de volumen a temperatura constante.
d) Justifica cómo afecta a la velocidad de reacción un aumento de la temperatura.
-
Velocidad de la reacción de descomposición del peróxido de hidrógeno (7535)
Analiza los siguientes datos sobre la descomposición del peróxido de hidrógeno y responde a las preguntas:
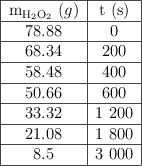
a) Calcula la rapidez de la reacción para cada uno de los tiempos de la tabla.
b) Calcula la rapidez promedio de la reacción.
c) Determina la rapidez instantánea de la reacción para el tiempo 1 000 s.
-
Velocidad de reacción en dos tubos de ensayo con distintas concentraciones
Se tienen dos tubos de ensayo en los que se agregan 3 mL de ácido sulfúrico al 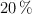 . En el primer tubo se deja caer una cinta de magnesio de 3 g y en el segundo tubo 3 g de cobre. Para culminar la reacción en el primer tubo transcurrieron 100 s y en el segundo tubo 300 s. ¿Cuál fue la velocidad de reacción para cada experiencia?
. En el primer tubo se deja caer una cinta de magnesio de 3 g y en el segundo tubo 3 g de cobre. Para culminar la reacción en el primer tubo transcurrieron 100 s y en el segundo tubo 300 s. ¿Cuál fue la velocidad de reacción para cada experiencia?
 Velocidad reacción
Velocidad reacción