-
EBAU Andalucía: química (junio 2023) - ejercicio B.5 (8033)
Dados los siguientes potenciales de reducción: 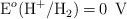 ;
; 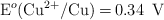 ;
; 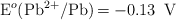 ;
; 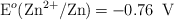 .
.
a) Explica, escribiendo las reacciones correspondientes, qué metal o metales producen desprendimiento de hidrógeno al ser tratados con un ácido.
b) Escribe las reacciones que tienen lugar en el ánodo y en el cátodo de la pila formada por los electrodos de Zn y Pb.
c) Escribe la notación de la pila formada por los electrodos del apartado b) y calcula su potencial.
-
Volumen y concentración de un oxidante para reacciones en medio ácido y básico (7785)
a) ¿Qué peso de 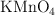 ha de pesarse para preparar 500 mL de disolución 0.100 N para ser utilizada como oxidante en medio ácido?
ha de pesarse para preparar 500 mL de disolución 0.100 N para ser utilizada como oxidante en medio ácido?
b) ¿Qué volumen de esta disolución se necesitaría para oxidar, en medio ácido, el Fe contenido en 10.0 mL de una disolución del 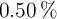 en
en 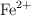 ?
?
c) Si la citada disolución se utiliza como oxidante en medio alcalino, ¿qué normalidad tendría?
-
Reducción del nitrobenceno a anilina con ditionito de sodio en medio básico (5516)
Se desean sintetizar 150 g de anilina a partir de nitrobenceno. Sabiendo que solo el 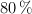 del nitrobenceno se transforma en anilina en la reacción:
del nitrobenceno se transforma en anilina en la reacción:

a) Realiza el ajuste de la ecuación por el método ion-electrón.
b) Identifica el agente reductor y el agente oxidante.
c) Calcula las masas de nitrobenceno, NaOH y de 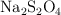 que serán necesarias para obtener la masa deseada de anilina.
que serán necesarias para obtener la masa deseada de anilina.
Datos en 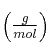 : H = 1 ; C = 12 ; S = 32 ; N = 14 ; O = 16 ; Na = 23.
: H = 1 ; C = 12 ; S = 32 ; N = 14 ; O = 16 ; Na = 23.
-
Verdadero o falso sobre cubas electrolíticas (5436)
Indica si son verdaderas o falsas las siguientes proposiciones, para el caso de una cuba electrolítica:
a) En el cátodo ocurre la oxidación.
b) En el ánodo ocurre la oxidación.
c) Los cationes fluyen hacia el cátodo.
d) En el ánodo los aniones ceden electrones.
-
Electrolisis de nitrato de plata: concentración y neutralización de iones resultantes (5338)
Se lleva a cabo la electrolisis de 3 L de disolución acuosa de nitrato de plata (0.25 M) haciendo circular una corriente de 6 A. Sabiendo que el rendimiento del proceso es del 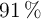 :
:
a) Escribe las semirreacciones que se llevan a cabo y realiza un esquema del proceso electrolítico, indicado la polaridad de los electrodos y la marcha de los electrones.
b) Calcula el tiempo que se hizo circular la corriente eléctrica mencionada, sabiendo que se depositaron 3.85 g del metal.
c) Calcula la concentración de todos los iones que quedan en disolución después del proceso de electrolisis.
d) Calcula el volumen de hidróxido de calcio 0.5 M o de ácido clorhídrico 0.4 M que habría que habría que agregar al finalizar la electrolisis para que el pH de la disolución resulte neutro.
 Proceso redox
Proceso redox