-
Estudio de un equilibrio químico homogéneo (7864)
En un recipiente de 5 litros de capacidad se introducen 0.1 mol de una sustancia A, 0.1 mol de una sustancia B y 0.1 mol de otra C, todas ellas gaseosas. El sistema alcanza el equilibrio a la temperatura de 500 K, de acuerdo a la ecuación química:
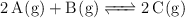
siendo entonces la presión en el recipiente de 2.38 atm. Se sabe que  está comprendida entre 100 y 150. Con estos datos:
está comprendida entre 100 y 150. Con estos datos:
a) Razona en qué sentido evolucionará la reacción hasta que alcance el equilibrio.
b) Calcula las concentraciones de cada especie en el equilibrio.
c) Determina el valor exacto de  .
.
d) ¿Cuál será la presión parcial de cada uno de los gases en el equilibrio?
e) Calcula el valor de  .
.
-
Análisis de la evolución del equilibrio de la descomposición del HI (6456)
En un recipiente de un litro de capacidad se introducen 0.4 moles de yoduro de hidrógeno, 0.2 moles de yodo y 0.1 moles de hidrógeno. La  para la descomposición del yoduro de hidrógeno ajustada a dos moles descompuestos, vale
para la descomposición del yoduro de hidrógeno ajustada a dos moles descompuestos, vale 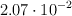 a una temperatura de 1 000 K.
a una temperatura de 1 000 K.
a) Discute que reacción se verá favorecida para que la reacción alcance el equilibrio.
b) Calcula el porcentaje que hay de cada gas en el equilibrio.
c) Si para el mismo equilibrio, inicialmente solo se hubiesen introducido 64 g de yoduro de hidrógeno, ¿qué tanto por ciento quedaría sin disociar una vez alcanzado el equilibrio? ¿Cuánto valdría el grado de disociación?
d) Discute y justifica la evolución del equilibrio si: i) se disminuye la temperatura (la descomposición es exotérmica); ii) se añade yodo; iii) se añade al recipiente un gas noble (que no reacciona) y iv) se añade un catalizador.
-
Equilibrio heterogéneo: formación de precipitados (1987)
Se disuelven 0.12 g de sulfato de aluminio en 1 L de agua y se toman 80 mL de esta disolución que son mezclados con 20 mL de una disolución de NaOH (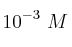 ). Determina si precipitará hidróxido de aluminio o no.
). Determina si precipitará hidróxido de aluminio o no.
Datos: Al = 27 ; S = 32 ; O = 16 ; 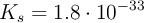 .
.
-
Comparar el cociente de reacción con la constante de equilibrio (598)
En un reactor de 3.5 L, y a 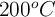 , se hacen reaccionar nitrógeno e hidrógeno para dar amoniaco. En un momento determinado, la composición del sistema es 0.249 moles de
, se hacen reaccionar nitrógeno e hidrógeno para dar amoniaco. En un momento determinado, la composición del sistema es 0.249 moles de 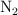 ,
, 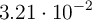 moles de
moles de 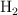 y
y 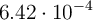 moles de
moles de 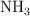 . Si la
. Si la  para la reacción, a esa temperatura, es 0.65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?
para la reacción, a esa temperatura, es 0.65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?
 Cociente reacción
Cociente reacción