-
EBAU Andalucía: química (junio 2024) - ejercicio C.1 (8271)
El 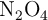 se descompone en
se descompone en 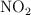 , estableciéndose el siguiente equilibrio:
, estableciéndose el siguiente equilibrio:

En un recipiente de 0.5 L se introducen 0.025 moles de 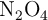 a
a 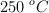 . Una vez alcanzado el equilibrio, la presión total es de 3.86 atm. Calcula:
. Una vez alcanzado el equilibrio, la presión total es de 3.86 atm. Calcula:
a) La presión parcial de cada gas en el equilibrio y el valor de  a la temperatura dada.
a la temperatura dada.
b) El grado de disociación del 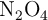 y el valor de
y el valor de  a la temperatura dada.
a la temperatura dada.
Dato: 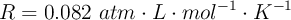
-
EBAU Andalucía: química (junio 2022) - ejercicio C.1 (7931)
En un matraz de 5 L se introducen 14.5 g de yoduro de amonio 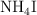 sólido. Cuando se calienta a 650 K se descompone según la ecuación:
sólido. Cuando se calienta a 650 K se descompone según la ecuación:
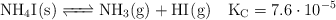
Calcula, una vez alcanzado el equilibrio:
a) El valor de  a 650 K y la presión total dentro del matraz.
a 650 K y la presión total dentro del matraz.
b) Los moles de 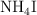 que quedan en el matraz.
que quedan en el matraz.
Datos: 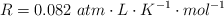 . Masas atómicas: H = 1 ; N = 14 ; I = 127.
. Masas atómicas: H = 1 ; N = 14 ; I = 127.
-
KP y KC de un equilibrio de disociación conocido el grado de disociación (6725)
A 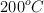 y presión de 1atm, el
y presión de 1atm, el 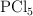 se disocia en
se disocia en 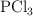 y
y 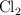 en un
en un 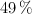 .Calcula:
.Calcula:
a)  y
y  .
.
b) El grado de disociación a la misma temperatura pero a 10 atm de presión.
-
Presión parcial del CO a la que es letal
La hemoglobina (Hb) puede formar un complejo con  o con
o con 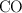 . Para la siguiente reacción, a temperatura corporal,
. Para la siguiente reacción, a temperatura corporal, 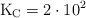 aproximadamente.
aproximadamente.

Cuando la relación ![\frac{[\ce{HbCO}]}{[\ce{HbO2}]} \frac{[\ce{HbCO}]}{[\ce{HbO2}]}](local/cache-TeX/3aab6fd7b82ea4d76fc01dd0b477bcb8.png) tiende a uno, la muerte es probable. ¿A qué presión parcial el
tiende a uno, la muerte es probable. ¿A qué presión parcial el 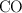 en el aire probablemente sea mortal? Asume que la presión parcial del
en el aire probablemente sea mortal? Asume que la presión parcial del  es 0.20 atm.
es 0.20 atm.
-
Presiones parciales y presión total en la descomposición del fosgeno
Para el equilibrio:
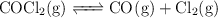
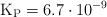 a determinada temperatura. Si al inicio la presión inicial del
a determinada temperatura. Si al inicio la presión inicial del 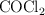 puro es 0.87 atm:
puro es 0.87 atm:
a) ¿Cuáles serán las presiones parciales en el equilibrio de 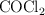 ,
, 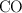 y
y 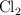 ?
?
b) ¿Cuál será la presión total en el equilibrio?
 Presión parcial
Presión parcial