-
Descomposición del ácido nítrico por la luz (8094)
El ácido nítrico se descompone, por acción de la luz, en dióxido de nitrógeno, oxígeno y agua. Si se obtienen 40.5 g de agua en la descomposición:
a) ¿Qué cantidad de ácido habrá reaccionado?
b) ¿Cuántos moles de dióxido de nitrógeno y oxígeno se obtienen?
c) ¿Qué volumen ocupa la mezcla de gases anterior en condiciones estándar (1 atm y 298 K)?
Masas atómicas: H = 1 ; N = 14 ; O = 16.
-
Ley de las proporciones definidas en la reacción entre nitrógeno y níquel (7985)
El níquel y el nitrógeno se combinan en la proporción 5:3 para formar el nitruro de níquel(II). Si se hacen reaccionar 60 g de Ni con 40 g de N, determina:
a) El elemento que sobra y el elemento que se consume totalmente tras la reacción, así como la cantidad que sobra y la cantidad necesaria del otro elemento para que no sobrase nada.
b) Cantidad de nitruro de níquel(II) que se forma.
c) Representa la ecuación química del proceso.
-
Ampliación: dióxido de carbono y energía que se genera al consumir alimentos (7980)
Los alimentos que comemos sufren un proceso de degradación en nuestro organismo por el que proporcionan la energía necesaria para el crecimiento y las funciones vitales. La ecuación de combustión de la glucosa es la que mejor describe el proceso:

Si la cantidad de alimentos que una persona consume al día equivale a una ingesta de 856 g de glucosa, calcula:
a) La masa de  que se produce como consecuencia de la combustión de tal cantidad de glucosa.
que se produce como consecuencia de la combustión de tal cantidad de glucosa.
b) La energía que se suministra al organismo.
c) El volumen de aire, medido a 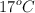 y 770 torr, que se necesita para la total combustión de la cantidad de glucosa indicada. Considera que el aire contiene un
y 770 torr, que se necesita para la total combustión de la cantidad de glucosa indicada. Considera que el aire contiene un 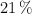 en volumen de oxígeno.
en volumen de oxígeno.
Datos: 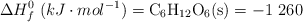 ;
; 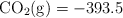 ;
; 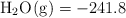
-
Volumen de aire para quemar un mol de glucosa (7881)
¿Qué volumen de aire, medido a 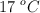 y 1.2 atm, teniendo en cuenta que el aire contiene un 21 % de oxígeno y un 79 % en moles de nitrógeno, se necesita para la total combustión de 1 mol de glucosa (
y 1.2 atm, teniendo en cuenta que el aire contiene un 21 % de oxígeno y un 79 % en moles de nitrógeno, se necesita para la total combustión de 1 mol de glucosa (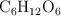 ) según la reacción:
) según la reacción:

-
Masa de carbonato de calcio que reacciona con HCl y volumen de CO2 producido (7808)
Al añadir ácido clorhídrico al carbonato de calcio se forma cloruro de calcio, dióxido de carbono y agua.
a) Escribe la reacción y calcula la cantidad, en kilogramos, de carbonato de calcio que reaccionará con 20 L de ácido clorhídrico 3 M.
b) ¿Qué volumen ocupará el dióxido de carbono obtenido, medido a 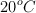 y 1 atm?
y 1 atm?
Datos: 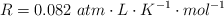 . Masas atómicas: C = 12 ; O = 16 ; Ca = 40.
. Masas atómicas: C = 12 ; O = 16 ; Ca = 40.
 Ajuste
Ajuste