-
EBAU Andalucía: química (junio 2023) - ejercicio C.4 (8043)
En una celda electrolítica que contiene 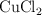 fundido se hace pasar una cierta cantidad de corriente durante 2 h, observándose que se deposita cobre metálico y se desprende dicloro. Basándote en las semirreacciones correspondientes:
fundido se hace pasar una cierta cantidad de corriente durante 2 h, observándose que se deposita cobre metálico y se desprende dicloro. Basándote en las semirreacciones correspondientes:
a) Determina la intensidad de corriente necesaria para depositar 15.9 g de Cu.
b) Calcula el volumen de 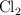 obtenido a
obtenido a 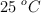 y 1 atm.
y 1 atm.
Datos: Cu = 63.5 ; 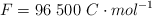 ;
; 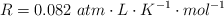 .
.
-
Tiempo para depositar medio gramo de talio en distintas disoluciones (6022)
Calcula el tiempo necesario para que una intensidad de corriente constante de 1.2 A deposite 0.500 g de:
a) 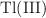 como elemento en un cátodo.
como elemento en un cátodo.
b) 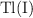 como
como 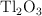 en un ánodo.
en un ánodo.
c) 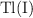 como elemento en un cátodo.
como elemento en un cátodo.
-
PAU Andalucía junio 2014: electroquímica y ley de Faraday
a) ¿Qué cantidad de electricidad es necesaria para que se deposite en el cátodo todo el oro contenido en un litro de disolución 0,1 M de cloruro de oro(III)?
b) ¿Qué volumen de dicloro, medido a una presión de 740 mm Hg y 25 ºC , se desprenderá del ánodo?
Datos: F = 96 500 C; 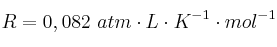 ; Au = 197; Cl: 35,5
; Au = 197; Cl: 35,5
-
Ley de Faraday 0001
¿Cuanto tiempo llevará el depositarse 100 g de aluminio con una corriente de 125 amperios?
-
Electroquímica: Ley de Faraday (2267)
¿Qué intensidad debe tener una corriente para que deposite 85 gramos de calcio en dos horas?
(Datos: Ca = 40 ; F = 96 500 C/mol)
 Faraday
Faraday