-
Ley de las proporciones definidas en la reacción entre nitrógeno y níquel (7985)
El níquel y el nitrógeno se combinan en la proporción 5:3 para formar el nitruro de níquel(II). Si se hacen reaccionar 60 g de Ni con 40 g de N, determina:
a) El elemento que sobra y el elemento que se consume totalmente tras la reacción, así como la cantidad que sobra y la cantidad necesaria del otro elemento para que no sobrase nada.
b) Cantidad de nitruro de níquel(II) que se forma.
c) Representa la ecuación química del proceso.
-
Repaso: masa de agua a partir de una cantidad de hidrógeno (7443)
¿Cuántos gramos de 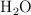 se producen si reaccionan 4.0 g de
se producen si reaccionan 4.0 g de 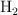 con exceso de
con exceso de  ?
?
-
Ley de Proust y de conservación de la masa en reacción entre hierro y oxígeno (6429)
Se hacen reaccionar 30 g de hierro con 6 g de oxígeno. Sabiendo que el hierro y el oxígeno se combinan en una relación 14:4. Determina:
a) Elemento sobrante.
b) Masa del elemento sobrante.
c) Cantidad de óxido formado.
-
Ley de Proust o de la proporción constante en la formación del MgO (6428)
Al combinar 28 g de magnesio con 14 g de oxígeno se forma el óxido de magnesio. Sabiendo que la relación entre sus masas es 3:2, calcula:
a) ¿Cuál es el elemento sobrante?
b) ¿Qué masa del elemento sobrante queda sin reaccionar?
-
Masa de agua necesaria para obtener una masa concreta de ácido carbónico (5951)
Para obtener 80 g de 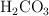 , ¿qué masa de
, ¿qué masa de 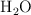 es necesaria?
es necesaria?
 Ley de Proust
Ley de Proust