-
Ampliación: Fórmula empírica y molecular de un compuesto orgánico líquido (7434)
a) Por análisis de un compuesto orgánico líquido se determina que contiene 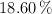 de carbono,
de carbono, 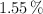 de hidrógeno,
de hidrógeno, 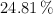 de oxígeno y el resto de cloro. Determina la fórmula empírica del compuesto.
de oxígeno y el resto de cloro. Determina la fórmula empírica del compuesto.
b) Al evaporar 1.29 g de dicha sustancia en un recipiente cerrado, a la temperatura de 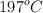 y presión atmosférica normal, estos ocupan un volumen de
y presión atmosférica normal, estos ocupan un volumen de 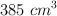 . ¿Cuál es la fórmula molecular del compuesto?
. ¿Cuál es la fórmula molecular del compuesto?
c) Al disolver 2.064 g del compuesto, en estado líquido, en agua destilada suficiente para obtener 500 mL de disolución, se detecta que esta tiene carácter ácido; 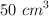 de ella se neutralizan con
de ella se neutralizan con 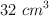 de una disolución obtenida al disolver 2 g de hidróxido de sodio puro en agua destilada, hasta conseguir 1 L de disolución. Escribe la posible ecuación química correspondiente a la reacción entre las sustancias e indica el número de moles de cada una de ellas que han reaccionado.
de una disolución obtenida al disolver 2 g de hidróxido de sodio puro en agua destilada, hasta conseguir 1 L de disolución. Escribe la posible ecuación química correspondiente a la reacción entre las sustancias e indica el número de moles de cada una de ellas que han reaccionado.
d) ¿Cuál es el pH de la disolución de hidróxido de sodio?
-
Fórmulas empírica y molecular de un compuesto orgánico gaseoso (7358)
Un compuesto orgánico gaseoso está formado por un 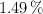 de hidrógeno, un
de hidrógeno, un 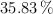 de oxígeno y un
de oxígeno y un 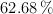 de carbono. Sabiendo que su densidad es de
de carbono. Sabiendo que su densidad es de 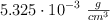 cuando se encuentra a una temperatura de
cuando se encuentra a una temperatura de 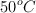 y una presión de 800 mm Hg.
y una presión de 800 mm Hg.
a) Calcula la fórmula empírica y molecular del compuesto.
b) Calcula el número de átomos de carbono que hay en 500 g del compuesto.
Datos: C = 12 ; H = 1 ; O = 16 ; 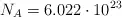
-
Fórmula molecular y nombre IUPAC de un compuesto inorgánico (7351)
Un compuesto formado por Fe, S y O tiene la siguiente composición porcentual: 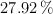 ,
, 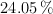 y
y 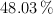 respectivamente. ¿Cómo se llama el compuesto?
respectivamente. ¿Cómo se llama el compuesto?
Masas atómicas: Fe = 55.8 ; S = 32.0 ; O = 16.0
-
Masa molar y fórmulas empírica y molecular de la aspirina (6895)
El ácido acetilsalicílico, conocido comercialmente como aspirina®, está formado por un 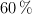 de carbono, un
de carbono, un 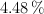 y el resto de oxígeno. Se evaporan 28.8 g de producto en un recipiente de 1.5 L, a
y el resto de oxígeno. Se evaporan 28.8 g de producto en un recipiente de 1.5 L, a 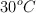 y 3 atm de presión. Calcula:
y 3 atm de presión. Calcula:
a) La fórmula empírica.
b) La masa molar.
c) La fórmula molecular.
-
Repaso: Fórmulas mínima y molecular de un ácido orgánico a partir de su neutralización (6689)
Un ácido orgánico está compuesto por 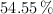 de C;
de C; 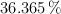 de O, y el resto de H. Para neutralizar completamente 0.264 g del mismo, se requieren 0.12 g de
de O, y el resto de H. Para neutralizar completamente 0.264 g del mismo, se requieren 0.12 g de 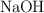 . Determina sus fórmulas mínima y molecular, sabiendo que su masa molecular es
. Determina sus fórmulas mínima y molecular, sabiendo que su masa molecular es 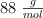 .
.
 Fórmula empírica
Fórmula empírica