-
Número de átomos en distintas cantidades de sustancias (8158)
Razona qué cantidad de las siguientes sustancias tiene mayor número de átomos:
a) 0.3 mol de  .
.
b) 14 g de dinitrógeno.
c) 67.2 L de helio gaseoso, en condiciones normales de presión y temperatura.
Masas atómicas: N = 14; O = 16; S = 32.
-
Masa y moles de una muestra de una mezcla de gases (6830)
Se ha obtenido una muestra de gas de un pozo y se ha comprobado que, a 1.0 atm y  , está formada por 4.0 L de
, está formada por 4.0 L de 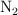 , 5.0 L de
, 5.0 L de 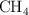 y 11.0 L de
y 11.0 L de  . Calcula:
. Calcula:
a) La cantidad de sustancia (mol) y la masa (g) de cada uno.
b) Las fracciones molares y las presiones parciales si comprimimos el gas hasta 2.0 atm.
-
Moles de un sistema gaseoso que sufre varias transformaciones y estado final (5765)
Un gas ideal se encuentra a una presión de 5.00 atm, a una temperatura de 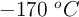 y ocupa un volumen de 50.0 L. El gas duplica su volumen mediante un proceso a temperatura constante, luego se enfría a volumen constante hasta alcanzar una presión de 1.50 atm. Determina:
y ocupa un volumen de 50.0 L. El gas duplica su volumen mediante un proceso a temperatura constante, luego se enfría a volumen constante hasta alcanzar una presión de 1.50 atm. Determina:
a) El número de moles de gas contenido en el sistema.
b) La presión al final de la expansión.
c) La temperatura final.
-
Volumen final de un gas al variar P, T y V
Una muestra de 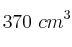 de oxígeno se recogió sobre agua a
de oxígeno se recogió sobre agua a 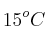 y una presión barométrica de 0,992 atm. ¿Qué volumen ocuparía esta muestra seca en condiciones normales de P y T?
y una presión barométrica de 0,992 atm. ¿Qué volumen ocuparía esta muestra seca en condiciones normales de P y T?
Datos: 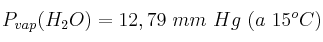
-
Masa de impurezas de un reactivo y volumen necesario del otro (5419)
El ácido sulfhídrico se forma por la reacción del no metal correspondiente con el hidrógeno molecular gaseoso.
a) Escribe la ecuación química que representa la reacción química descrita.
b) Si reaccionan 140 g del no metal, cuya pureza es de 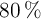 , calcula la masa de impurezas que no reaccionan y el volumen de hidrógeno, expresado en litros, que reaccionarán, medidos en condiciones normales.
, calcula la masa de impurezas que no reaccionan y el volumen de hidrógeno, expresado en litros, que reaccionarán, medidos en condiciones normales.
 Leyes ponderales
Leyes ponderales