-
[P(1958)] EBAU Andalucía: química (junio 2012) - ejercicio B.3 (8452)
Para ver el enunciado y las respuestas del ejercicio que se resuelve en el vídeo puedes hacer clic en este enlace.
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio C.2 (8243)
Para la siguiente reacción:

Calcula:
a) La entalpía de reacción estándar.
b) La variación de energía interna (calor a volumen constante) a 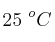 .
.
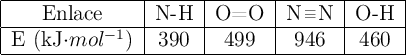
Datos: 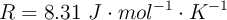
-
Energía contenida en una bombona de butano (6998)
El butano es un hidrocarburo formado por 4 átomos de carbono y 10 átomos de hidrógeno. Su combustión produce una intensa llama azul, muy calorífica.
Las bombonas de butano se venden con una cantidad de 12.5 kg de gas. Suponiendo que no existen pérdidas de calor, calcula:
a) El calor producido al combustionar una bombona de butano.
b) La cantidad de agua que podremos calentar a 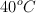 si partimos de una temperatura de
si partimos de una temperatura de 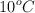 , con ese calor.
, con ese calor.
c) El dinero que deberíamos gastar para vaporizar una piscina olímpica de 375 000 L que se encuentra ya a 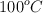 , sabiendo que cada bombona de butano cuesta 13.30 euros.
, sabiendo que cada bombona de butano cuesta 13.30 euros.
DATOS: 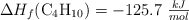 ;
; 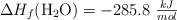 ;
; 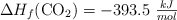 ;
; 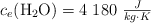 ;
; 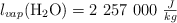 ; C = 12 ; H = 1 ; O = 16.
; C = 12 ; H = 1 ; O = 16.
-
Entalpía molar del propano a partir de la combustión en un calorímetro (6596)
Calcula la entalpía molar de la reacción de combustión del propano sabiendo que, al quemarse completamente 50 g de propano, el calor liberado hace que aumente la temperatura de 10 kg de agua desde 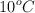 hasta
hasta 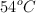 .
.
Datos: 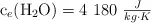 ; C = 12 ; H = 1.
; C = 12 ; H = 1.
-
Fórmula molecular de un compuesto desconocido y resultado de su combustión (6361)
Se tiene en una botella una sustancia orgánica desconocida, de la que se sabe que su concentración es de 0.250 M. Se toman 200 mL de esa botella y se destila completamente, obteniéndose un líquido puro que pesa 4.3 g. La composición centesimal de ese líquido es de 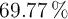 de C,
de C, 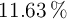 de H y el resto de oxígeno.
de H y el resto de oxígeno.
a) Calcula su fórmula molecular.
b) Si se quema completamente, calcula el volumen de dióxido de carbono, medido a 1 atm y 300 K, que se produce.
c) Calcula la entalpía de combustión, sabiendo que la entalpía de formación del vapor de agua es 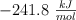 y la del dióxido de carbono es
y la del dióxido de carbono es 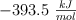 .
.
d) Dibuja una posible estructura de la molécula y escribe su nombre.
 Entalpía
Entalpía