-
Selectividad junio 2013: ecuación cinética, orden y velocidad de reacción (2158)
Para la reacción:
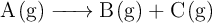
el valor de la constante de velocidad a una cierta temperatura es 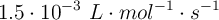 .
.
a) ¿Cuál es el orden de la reacción?
b) ¿Cuál es la ecuación de velocidad?
c) A esa misma temperatura, ¿cuál será la velocidad de la reacción cuando la concentración de A sea 0.242 M?
-
Velocidad, orden de reacción y constante de velocidad (1934)
En el estudio de la cinética de una reacción química se han realizado cuatro experimentos y se han obtenido los siguientes resultados, a 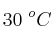 :
:
![\begin{tabular}{| l | c | c | c | } \hline &[A]_0 (M)&[B]_0 (M)&v (M\cdot s^{-1})\\\hline Exp 1 &0.01&0.02&0.524\\\hline Exp 2&0.01&0.06&4.716\\\hline Exp 3&0.02&0.06&9.432\\\hline Exp 4&0.04&0.02&2.096\\\hline \end{tabular} \begin{tabular}{| l | c | c | c | } \hline &[A]_0 (M)&[B]_0 (M)&v (M\cdot s^{-1})\\\hline Exp 1 &0.01&0.02&0.524\\\hline Exp 2&0.01&0.06&4.716\\\hline Exp 3&0.02&0.06&9.432\\\hline Exp 4&0.04&0.02&2.096\\\hline \end{tabular}](local/cache-TeX/26d4ba242ba01822f486cc6d60c42054.png)
Determina:
a) El orden total de reacción.
b) El valor de la constante de equilibrio a esa temperatura.
c) Si el proceso fuera elemental, ¿cuál sería su molecularidad?
-
Cuestión cinética química 0010
La reacción 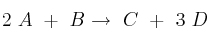 es un proceso elemental.
es un proceso elemental.
a) ¿Cuáles son los órdenes parciales y el orden total de reacción?
b) ¿Cuál es su ecuación cinética?
c) ¿Y su molecularidad?
d) Calcula la constante de velocidad si para concentraciones iniciales de A y B 0,1 M se ha obtenido un valor de la velocidad de 0,012 M/s.
-
Cuestión cinética química 0009
En presencia de 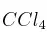 , el
, el 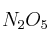 se disocia en oxígeno y dióxido de nitrógeno. Si la cinética de este proceso es de orden uno y su constante de velocidad, a 30 ºC, es
se disocia en oxígeno y dióxido de nitrógeno. Si la cinética de este proceso es de orden uno y su constante de velocidad, a 30 ºC, es 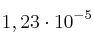 :
:
a) ¿Cuáles son las unidades de k?
b) ¿Cuál será el valor de v a 30 ºC si la concentración inicial de reactivo es 0,5 M?
c) Si la reacción fuese a 50 ºC, ¿aumentaría la velocidad de reacción?
d) Si la concentración inicial del reactivo fuese 0,001 M, ¿cuál sería la velocidad del proceso?
-
Cuestión cinética química 0007
La velocidad de reacción del proceso 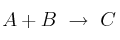 sigue la ecuación:
sigue la ecuación:
![v = k\ [A]^2[B] v = k\ [A]^2[B]](local/cache-TeX/13aec6ce51ed0e664884a61f239e742e.png)
A partir de estos datos responde a las siguientes cuestiones:
a) Indica el orden parcial de cada reactivo y el orden total de la reacción.
b) ¿Es un proceso bimolecular?
c) Si aumentamos la temperatura del sistema, ¿afectaría a esta reacción?
d) Si duplicamos la concentración inicial de A, ¿cómo variará la velocidad del proceso? ¿Y si triplicamos la concentración inicial de B?
 Constante velocidad
Constante velocidad