Sabiendo que la solubilidad de la sal de mesa es ![]() a
a ![]() , se desea saber:
, se desea saber:
a) ¿Es posible disolver 70 g de sal en 150 g de agua?
b) ¿Qué masa de solución se puede obtener si se dispone de 95 g de sal?
c) ¿Es posible disolver completamente 10 g de sal en 50 g de agua?
Sobre tu mesa tienes dos esferas, una de hierro y la otra de madera. Ambas tienen 1 kg de masa:
a) ¿Tienen el mismo tamaño o una es mayor que la otra? En ese caso, ¿cuál es mayor?
b) ¿Cuál pesa más? ¿Cuál es más densa?
c) ¿Cuál haría subir más el nivel de agua si sumergimos cada una en una probeta?
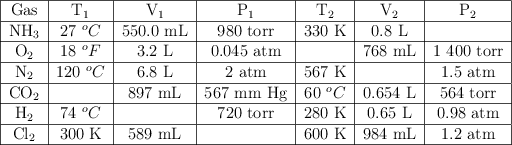
A un gas que está dentro de un recipiente de 4 L se le aplica una presión absoluta de 1 020 mm de Hg y su temperatura es de ![]() . ¿Cuál será su temperatura cuando recibe una presión absoluta de 920 mm de Hg y su volumen es de 3.67 L?
. ¿Cuál será su temperatura cuando recibe una presión absoluta de 920 mm de Hg y su volumen es de 3.67 L?
Un balón que en la ciudad A tiene un volumen de 3.5 litros se lleva a la ciudad B y se encuentra que su volumen es de 3.2 litros. ¿Cuál de las dos ciudades tiene mayor presión atmosférica si la temperatura es igual en ambas?
Cierta cantidad de nitrógeno ocupa un volumen de 30 L a una presión de 1 200 torr. ¿Qué volumen ocupará a 500 torr?
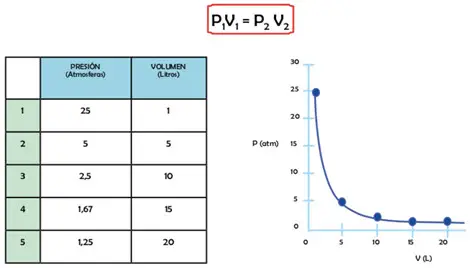
Si se quisiera realizar una medición 6 en la tabla de resultados, cuando la presión sea de una atmosfera (1 atm) el volumen será:
Si un salón se encuentra a una presión de 1 atmósfera y el aire que contiene ocupa un volumen de ![]() a
a ![]() . ¿Cuál será la temperatura en K del mismo salón cuando el aire ocupe un volumen de
. ¿Cuál será la temperatura en K del mismo salón cuando el aire ocupe un volumen de ![]() ? Debes suponer que la presión en el salón es constante.
? Debes suponer que la presión en el salón es constante.
En el laboratorio se obtienen los siguientes datos sobre un sistema gaseoso que ocupa un volumen fijo de 5 L:
![]()
a) ¿Qué ley de los gases se cumple? ¿Cuál es el valor de la constante?
b) Representa gráficamente la isócora del experimento.
c) ¿Cuál sería la temperatura esperada cuando la presión sea 2.8 atm?
Se ensaya un tanque que resiste una presión de 36 atm. Se llena de aire a ![]() y 18 atm. ¿Ofrece seguridad para someterlo, una vez lleno, a una temperatura de
y 18 atm. ¿Ofrece seguridad para someterlo, una vez lleno, a una temperatura de ![]() ?
?
 Ejercicios FyQ
Ejercicios FyQ